Окислительно-восстановительные реакции являются одной из основных классических реакций в химии. Они происходят при взаимодействии оксидантов и восстановителей, когда происходит перенос электронов между реагирующими веществами. В данной статье рассмотрим принципы и применение окислительно-восстановительных реакций, особенно в соли и металлах.
Окисление представляет собой процесс, в ходе которого атом или ион теряет один или несколько электронов. Восстановление, в свою очередь, является обратной реакцией, при которой атом или ион получает один или несколько электронов. На основе этих процессов возможно создание различных реакций и химических соединений.
В соли и металлов наиболее распространенными оксидантами являются кислород и кислородсодержащие соединения, например, хлор, бром, перекись водорода и другие. Основными восстановителями могут выступать металлы, ионы металлов или простые вещества, такие как водород и углерод.
Окислительно-восстановительные реакции находят широкое применение в различных областях химии и промышленности. Они используются в процессе получения металлов из их руд, в производстве пищевых продуктов и веществ, а также в биохимии для осуществления множества жизненно важных процессов.
Изучение принципов окислительно-восстановительных реакций соли и металла позволяет более глубоко понять химические процессы, происходящие в природе и в промышленности. Это предоставляет возможность разработки новых методов синтеза веществ и создания новых материалов с различными свойствами и функциональностью.
Принципы окислительно-восстановительных реакций
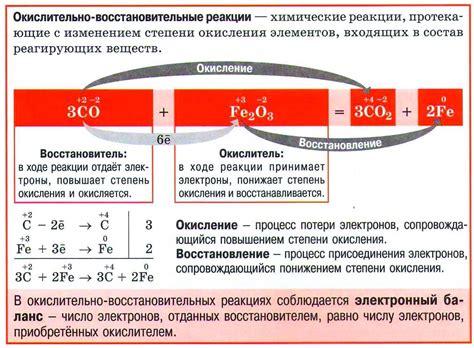
Окислительно-восстановительные реакции (ОВР) являются одним из важных видов химических реакций, которые происходят за счет переноса электронов между реагирующими веществами. ОВР основываются на двух основных принципах: окислении и восстановлении.
Окисление - это процесс, при котором одно вещество теряет электроны, а второе вещество получает электроны. Вещество, отдавшее электроны, называется окислителем, так как оно окисляет другое вещество. Вещество, получившее электроны, называется восстановителем, так как оно восстанавливает другое вещество.
ОВР можно представить в виде электронных переносов, где происходит поток электронов от окислителя к восстановителю. Окисление и восстановление происходят одновременно, поэтому эти процессы неразрывно связаны между собой.
Примером ОВР может служить реакция между металлом и кислотой. Когда металл взаимодействует с кислотой, металл окисляется, отдавая электроны, а водородные ионы кислоты восстанавливаются, получая эти электроны. Результатом такой реакции является образование соли и выделение водорода.
Окислительно-восстановительные реакции находят широкое применение в различных областях, включая химическую промышленность, электрохимию, аналитическую химию и многое другое. Знание принципов ОВР позволяет понять химические процессы, происходящие во многих системах и имеющие важное значение для понимания и применения химии в повседневной жизни.
Что такое окисление и восстановление
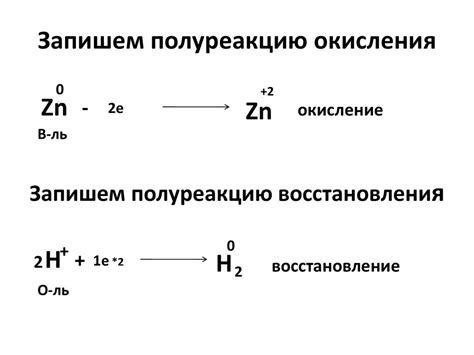
Окисление – это процесс, при котором вещество теряет электроны. Окислитель – это вещество, которое способно принимать электроны и тем самым окислять другое вещество. При окислении образуются окислы – химические соединения, в которых атомы вещества имеют более высокую степень окисления.
Восстановление – это противоположный процесс, при котором вещество поглощает электроны и увеличивает степень своего окисления. Восстановитель – это вещество, которое может отдать электроны и тем самым восстанавливать другое вещество. В результате восстановления образуются восстановленные формы вещества.
Окислительно-восстановительные реакции соли и металла – это реакции, в которых происходит передача электронов между металлом и ионами металла, находящимися в растворе соли. Металл выступает в качестве восстановителя, отдавая свои электроны, а ионы металла – вещества, которое окисляется под действием металла. В результате таких реакций образуются оксиды металлов или ионы металла в более низкой степени окисления.
Окислительно-восстановительные реакции соли и металла широко используются в различных областях науки и техники. Например, они играют важную роль в электрохимических процессах, таких как производство металлов, аккумуляторы, производство электроэнергии. Также эти реакции используются в аналитической химии для определения содержания металлов в различных веществах.
Реакции соли с металлом
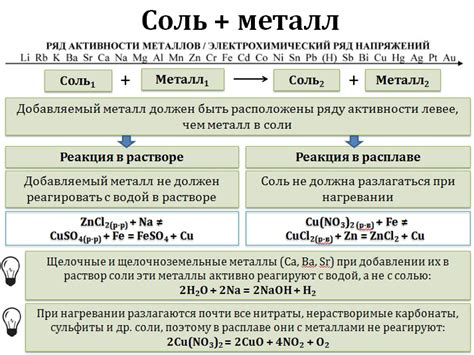
Окислительно-восстановительные реакции соли и металла представляют собой химические процессы, в которых происходит переход электронов между реагентами. В таких реакциях соль выступает в качестве окислителя, получая электроны от металла, который выступает в роли восстановителя.
Реакции соли с металлом широко применяются в различных областях науки и промышленности. Например, в химическом синтезе эти реакции позволяют получать различные соединения и материалы. Также они используются в электрохимии для создания электродов и проводников электричества.
Одним из примеров реакции соли с металлом является реакция железа с хлоридом железа. При контакте этих веществ происходит образование оксида железа и выделение хлора. Эта реакция применяется в промышленности для получения хлорида железа, который используется в производстве красителей и лекарственных препаратов.
Реакции соли с металлом имеют широкий спектр возможных реагентов и продуктов, поэтому они могут быть использованы для получения различных соединений с заданными свойствами. Такая гибкость делает эти реакции важными инструментами в химической индустрии и научных исследованиях.
Применение окислительно-восстановительных реакций

Окислительно-восстановительные реакции широко применяются в различных областях науки и техники. Они играют важную роль в процессах синтеза химических соединений, анализе веществ, электрохимии и других областях.
В химической промышленности окислительно-восстановительные реакции используются для получения различных соединений. Например, в процессе синтеза органических соединений часто используются окислители, которые окисляют начальные вещества и превращают их в нужные продукты. Также эти реакции применяются при получении металлов из руд и в процессе обработки металлических материалов.
Окислительно-восстановительные реакции широко используются в аналитической химии для определения концентрации веществ. Методы, основанные на окислительно-восстановительных реакциях, позволяют провести качественный и количественный анализ различных проб, включая пищевые продукты, медицинские препараты, промышленные отходы и другие вещества.
Электрохимия также тесно связана с окислительно-восстановительными реакциями. В процессе электролиза различных растворов и веществ происходят окислительно-восстановительные реакции, которые позволяют получать различные вещества или проводить очистку растворов. Также в электрохимии используются специальные оксидоредукционные системы, которые позволяют преобразовывать электрическую энергию в химическую и наоборот.
Окислительно-восстановительные реакции находят применение не только в науке, но и в повседневной жизни. Например, при готовке пищи окислительно-восстановительные реакции помогают придать продуктам нужные вкусовые и ароматические свойства. Также эти реакции используются при консервировании пищевых продуктов для увеличения их срока хранения.
В заключение, окислительно-восстановительные реакции имеют широкое применение в различных областях науки и техники. Они играют важную роль в процессе синтеза и анализа веществ, электрохимии и повседневной жизни. Понимание принципов этих реакций позволяет разрабатывать новые методы получения и использования химических соединений, а также проводить исследования в различных областях химии.
Окислительно-восстановительные реакции в промышленности

Окислительно-восстановительные реакции играют важную роль в промышленности, особенно в процессах производства химических соединений и материалов.
В процессе синтеза промышленных химических соединений, окислительно-восстановительные реакции используются для превращения одних веществ в другие. Например, окислительно-восстановительные реакции могут использоваться для превращения сырья в ценные химические соединения, которые в дальнейшем могут быть использованы в производстве лекарств, пластмасс, красителей и других продуктов.
В промышленном производстве, окислительно-восстановительные реакции также могут использоваться для изготовления различных материалов. Например, при производстве металлов окислительно-восстановительные реакции могут быть использованы для извлечения металлов из их руды или для поверхностной обработки металлических изделий.
Окислительно-восстановительные реакции также имеют широкое применение в области энергетики. В процессе генерации электроэнергии, окислительно-восстановительные реакции используются в топливных элементах и аккумуляторах, где происходит преобразование энергии химических веществ в электрическую энергию.
Исходя из этого, можно сделать вывод, что окислительно-восстановительные реакции являются неотъемлемой частью промышленных процессов. Они позволяют получать ценные химические соединения, изготавливать материалы и генерировать электроэнергию. Без использования окислительно-восстановительных реакций, многие процессы производства были бы невозможны или намного более сложны в реализации.
Окислительно-восстановительные реакции в медицине
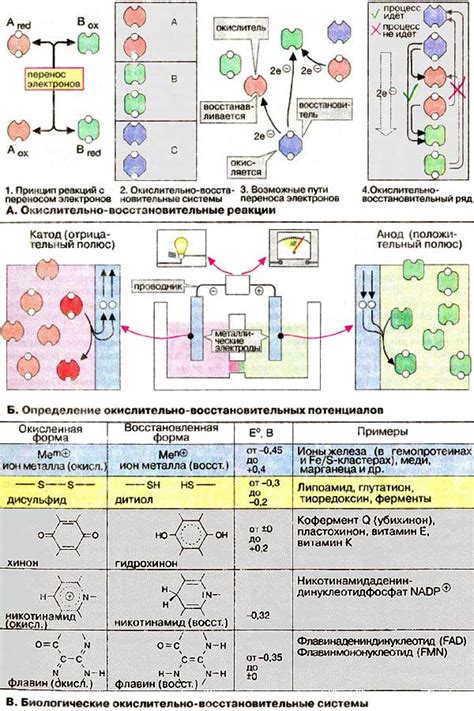
Окислительно-восстановительные реакции играют важную роль в медицине, применяются для диагностики заболеваний и лечения.
Одним из ярких примеров применения окислительно-восстановительных реакций в медицине является анализ крови на уровень глюкозы. Для определения содержания глюкозы в крови используется метод глюкозооксидазного окисления. Этот метод основан на реакции окисления глюкозы ферментом глюкозооксидазой, при которой образуется пероксид водорода, который затем окисляется с помощью пероксидазы, сопровождаясь появлением окрашенного продукта. Такие анализы позволяют выявить диабет и контролировать уровень глюкозы у пациентов.
Еще одним примером применения окислительно-восстановительных реакций в медицине является использование антиоксидантов в качестве добавки к пище и лекарствам. Антиоксиданты предотвращают окисление липидов, ДНК и белков клеток организма, что является причиной различных заболеваний, таких как рак или сердечно-сосудистые заболевания. Антиоксиданты способствуют уменьшению окислительного стресса, укрепляют иммунную систему и замедляют старение клеток.
Также, окислительно-восстановительные реакции находят применение в области медицинской дезинфекции. Например, перекись водорода используется в качестве антисептика для обработки ран и ожогов. При взаимодействии с микроорганизмами, перекись водорода стимулирует окислительные процессы и эффективно уничтожает патогенные бактерии, грибки и вирусы. Благодаря этому свойству перекиси водорода она активно применяется в медицинских учреждениях и домашней медицине.
Окислительно-восстановительные реакции в аналитической химии
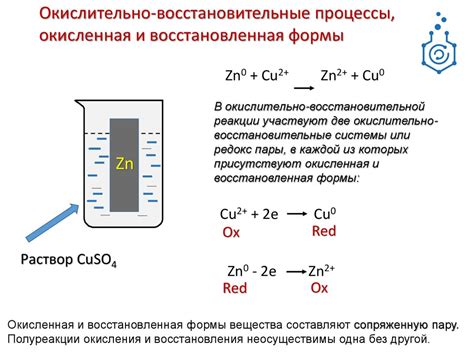
Окислительно-восстановительные реакции играют важную роль в аналитической химии, поскольку позволяют определить содержание различных веществ в образцах. В основе этих реакций лежит процесс передачи электронов между веществами, что позволяет определить степень окисления или восстановления анализируемых веществ.
Аналитическая химия включает в себя множество методов анализа, основанных на окислительно-восстановительных реакциях. Например, окислительно-восстановительные реакции могут быть использованы для определения концентрации различных веществ в растворе или для выделения и определения металлов в минералах или рудах.
Для проведения анализа методами окислительно-восстановительных реакций необходимо подобрать соответствующий реагент, который будет активно взаимодействовать с анализируемым веществом. Например, хлоргидрат сернистого газа может быть использован в качестве реагента для определения железа в растворе, поскольку сернистый газ обладает сильными окислительными свойствами и окисляет железо до высокого окислительного состояния.
После проведения окислительно-восстановительной реакции необходимо проанализировать полученные результаты. Это может быть сделано с помощью изменения цвета раствора, осадка, изменения pH-значения или других параметров. Полученные данные позволяют сделать заключение о содержании определенного элемента или соединения в анализируемом пробирке или образце.
Аналитическая химия и окислительно-восстановительные реакции находят применение в различных областях, включая медицину, фармацевтику, пищевую промышленность, экологию и другие. Они позволяют определить содержание металлов, органических веществ, витаминов и других веществ в образцах и продуктах, что является важным для контроля качества и безопасности продукции.
Вопрос-ответ

Какие принципы лежат в основе окислительно-восстановительных реакций соли и металла?
В основе окислительно-восстановительных реакций соли и металла лежат принципы окисления и восстановления. Окисление - это процесс передачи электронов от одного вещества к другому, при котором одно из веществ теряет электроны, а другое - получает. Восстановление - это обратный процесс, при котором вещество получает электроны и тем самым снижает свою степень окисления. В таких реакциях соль выступает в роли окислителя, а металл - в роли восстановителя.
Какие применения имеют окислительно-восстановительные реакции соли и металла?
Окислительно-восстановительные реакции соли и металла имеют широкое применение в различных областях. Например, они используются в химической промышленности для получения различных продуктов, таких как металлы, соединения и сплавы. Также эти реакции используются в аналитической химии для определения содержания веществ в образцах. Кроме того, окислительно-восстановительные реакции соли и металла применяются в электрохимии, где они являются основой для работы батарей, элементов питания и других устройств. Необходимо отметить также применение этих реакций в медицине, экологии и других областях.
Какие перспективы развития окислительно-восстановительных реакций соли и металла?
Окислительно-восстановительные реакции соли и металла имеют большой потенциал для развития и применения в различных сферах. Одной из перспектив является разработка новых методов синтеза веществ с использованием окислительно-восстановительных реакций, что поможет упростить и ускорить процесс производства различных материалов и соединений. Кроме того, эти реакции могут быть использованы для создания более эффективных источников энергии, таких как солнечные батареи и элементы питания. Также важным направлением развития является исследование новых катализаторов и реагентов, которые увеличат скорость реакций, снизят их стоимость и сделают их более экологически безопасными.
