Окислительно-восстановительные реакции являются одним из основных видов химических реакций, в которых происходит передача электронов между веществами. Металлы, благодаря своей способности отдавать электроны, являются активными веществами при проведении таких реакций. Давайте рассмотрим несколько примеров таких реакций с участием металлов.
Одним из наиболее известных примеров окислительно-восстановительных реакций металлов является реакция между цинком и серной кислотой. При соединении этих веществ образуется сульфат цинка и выделяется водород. Цинк, будучи активным металлом, отдает два электрона серной кислоте, которая, в свою очередь, претерпевает окисление. Реакция сопровождается выделением энергии и тепла.
Еще одной интересной окислительно-восстановительной реакцией с участием металлов является реакция между алюминием и хлоридом меди(II). Реакция происходит при нагревании и сопровождается образованием хлорида алюминия и меди. В данной реакции, алюминий отдает три электрона и переходит в положительное окисление, а медь претерпевает восстановление, получая электроны от алюминия.
Окислительно-восстановительные реакции металлов являются основой для многих промышленно важных процессов, таких как производство металлов, гальваническое покрытие и аккумуляторные батареи. Понимание и изучение этих реакций не только расширяет наше знание в области химии, но и помогает в разработке новых материалов и технологий.
Что такое окислительно-восстановительные реакции металлов?
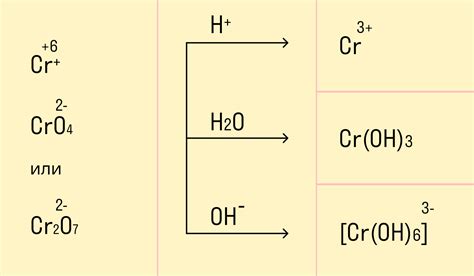
Окислительно-восстановительные реакции металлов - это химические процессы, в которых металлы способны терять или получать электроны. Отношение металла к окислителю и восстановителю в таких реакциях позволяет металлам проявлять различные свойства, включая жаропрочность, коррозионную стойкость и способность образовывать соединения с другими веществами.
Металлы, как правило, имеют отрицательный стандартный электродный потенциал, что делает их хорошими восстановителями. Во время окисления металлы теряют электроны, становясь положительно заряженными и превращаясь в катионы. Эти электроны передаются оксиданту, который в результате становится восстановленным.
Примером окислительно-восстановительной реакции металлов является реакция железа с кислородом, которая приводит к образованию оксида железа (III). В этой реакции железо теряет электроны и окисляется, а кислород получает электроны и восстановливается.
Свойства металлов, обусловленные окислительно-восстановительными реакциями, имеют широкое применение в различных отраслях промышленности. Например, некоторые металлы используются в производстве коррозионно-стойких материалов, электрических проводов и батарей. Понимание окислительно-восстановительных реакций металлов позволяет разработать эффективные способы защиты металлических конструкций от окисления и гниения.
Okislenie i vosstanovlenie v khimii

V khimii okislenie i vosstanovlenie – eto dvoinaya protsess, kotoraya svyazana s peredachey elektronov mezhdu reagentami. Okislenie oznachaet utratu elektronov reagentom, v to vremya kak vosstanovlenie oznachaet poluchenie elektronov reagentom.
Reaktsii okisleniya i vosstanovleniya chasto proyavlyayutsya v khimicheskikh reaktsiyakh, svyazannykh s metallami. Naprimer, pri vzaimodeystvii metalla s kislorodom, metally okislyayutsya, to est perehodyat v sostoyanie s bolshim stepenyu okisleniya. Eto mozhno videt pri reaktsii zheleza s kislorodom, pri kotoroy jelezo okislyaetsya do formy okislivogo zhelaza.
Vosstanovlenie metalla chasto proiskhodit pri vzaimodeystvii s kislorodnymi soedineniyami. Naprimer, pri reaktsii jodida kaltsiya s khloridom nikelya, nikalj vosstanavlivaetsya v sostoyanie s men'shey stepenyu okisleniya, a iod poluchayet elektron ot nikelya, stado nakhozhdja v bol'shej stepeni okisleniya.
Окислительно-восстановительные реакции: основные принципы
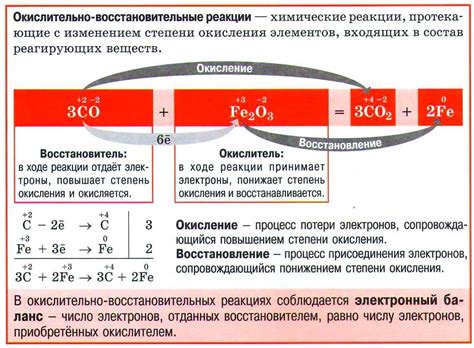
Окислительно-восстановительные реакции являются одним из важнейших классов химических реакций, при которых происходит перенос электронов между веществами. В таких реакциях одно вещество, действующее как окислитель, получает электроны и тем самым уменьшает свою окислительную способность, а другое вещество, действующее как восстановитель, отдает электроны и увеличивает свою окислительную способность.
Главный принцип окислительно-восстановительных реакций заключается в том, что изменение окислительного состояния одной частицы сопровождается противоположным изменением окислительного состояния другой частицы. Таким образом, окислительно-восстановительные реакции неразрывно связаны между собой именно переносом электронов.
Важно отметить, что в окислительно-восстановительных реакциях могут участвовать как металлы, так и их соединения. В процессе окисления металлы образуют положительные ионы, которые в результате восстановления превращаются обратно в нейтральные атомы металла. Вместе с тем, окисление металлов может привести к образованию различных оксидов, гидроксидов, солей и других соединений, что открывает широкий спектр приложений окислительно-восстановительных реакций в различных областях науки и промышленности.
Окислительно-восстановительные реакции являются фундаментальной основой металлургических процессов, катализаторов, электрохимических систем и многих других важных технологий. Изучение и понимание принципов таких реакций позволяет разрабатывать новые способы синтеза веществ и улучшать существующие технологии, что способствует прогрессу и развитию научных и промышленных отраслей.
Окислительно-восстановительные реакции металлов в промышленности

Металлы широко используются в промышленности, и их окислительно-восстановительные реакции играют важную роль во многих процессах производства. Одной из таких реакций является окисление железа в процессе производства стали.
Для производства стали необходимо осуществить восстановление железа из его оксидов. Для этого проводят окислительно-восстановительные реакции с использованием различных веществ. Например, при использовании кокса или коксового газа происходит частичное окисление кокса, что позволяет восстановить железо из его оксидов. Полученная сталь имеет различные свойства и может использоваться в различных отраслях промышленности.
Другим примером окислительно-восстановительной реакции металлов в промышленности является процесс гальванизации. В этом процессе на поверхность металлического изделия наносят слой другого металла при помощи окислительно-восстановительной реакции. Например, при гальванизации железных изделий их подвергают обработке в растворе цинка. В результате окисления цинка и восстановления железа на поверхности образуется слой цинка, который защищает железо от коррозии и придает изделию привлекательный внешний вид.
Необходимо отметить, что окислительно-восстановительные реакции металлов в промышленности играют также важную роль в области электроэнергетики. Например, аккумуляторы используют окислительно-восстановительные реакции для хранения и выделения электрической энергии. В процессе зарядки аккумулятора происходит окисление свинца и восстановление свинцового оксида, что позволяет запасать энергию, а при разрядке происходит обратная реакция.
Влияние окислительно-восстановительных реакций металлов на окружающую среду

Окислительно-восстановительные реакции металлов играют важную роль в самых разных процессах, включая химические реакции, происходящие в окружающей нас среде. Многие металлы, такие как железо, алюминий и медь, активно взаимодействуют с кислородом, в результате чего происходит окисление металла и образование соответствующих окислов. При этом кислород снижает свою валентность и восстанавливается.
Один из важных аспектов окислительно-восстановительных реакций металлов связан с их влиянием на окружающую среду. Например, при окислении железа путем ржавления происходит образование ржавчины на металлической поверхности. Такая окислительная реакция может привести к повреждению металла и его разрушению, что может быть особенно опасно в случае конструкций из железа, например, мостов или зданий.
Окисление металлов также может иметь отрицательное влияние на биологические системы и живые организмы. Некоторые металлы, например свинец или ртуть, могут образовывать токсические соединения при окислении, что может привести к отравлениям и заболеваниям у животных и людей. Поэтому контроль и предотвращение окислительных реакций металлов имеет важное значение для сохранения экологической и общественной безопасности.
Однако не все окислительно-восстановительные реакции металлов являются негативными или опасными. Некоторые из них, например, используются в процессе производства энергии в гальванических элементах или аккумуляторах. Кроме того, некоторые металлы, как катализаторы, участвуют в окислительно-восстановительных реакциях в промышленных процессах, приводящих к производству полезных продуктов.
Таким образом, окислительно-восстановительные реакции металлов имеют сложное и разнообразное влияние на окружающую среду. Естественные процессы окисления и восстановления металлов могут приводить к разрушению и загрязнению, однако контролируемые реакции могут использоваться в различных сферах деятельности человека для получения энергии либо производства полезных продуктов.
Контроль окислительно-восстановительных реакций металлов

Окислительно-восстановительные реакции металлов являются важным объектом изучения в химии и находят широкое применение в различных сферах, включая промышленность и науку. Для эффективного контроля таких реакций необходимо иметь средства анализа и методы определения окислительно-восстановительных свойств металлов.
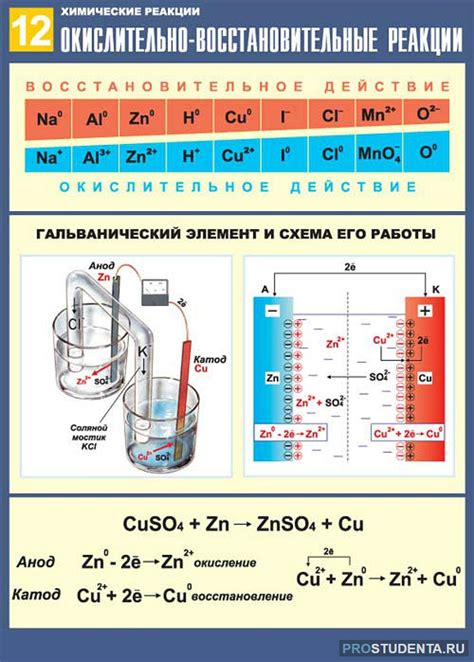
Одним из методов контроля окислительно-восстановительных реакций металлов является использование гальванических элементов. Гальванический элемент представляет собой совокупность двух полуреакций – окислительной и восстановительной, которые происходят на электродах. Изменение электродного потенциала при наличии различных соединений или металлов позволяет определить их окислительные и восстановительные свойства.
Другим способом контроля окислительно-восстановительных реакций металлов является использование органических или неорганических веществ в качестве индикаторов. Индикаторы – это вещества, изменяющие свой цвет при изменении окислительно-восстановительного состояния соединения или металла. Например, при реакции окисления железа, раствор перманганата калия меняет цвет с фиолетового на зеленый, что позволяет определить, что железо в реакции окислено.
Третим методом контроля окислительно-восстановительных реакций металлов является использование специальных приборов, таких как вольтметр или амперметр. Эти приборы позволяют измерять электрический ток, который возникает в результате окислительно-восстановительной реакции. Путем анализа электрического тока можно определить характер и интенсивность реакции.
Таким образом, контроль окислительно-восстановительных реакций металлов включает использование гальванических элементов, индикаторов и специальных приборов. Эти методы позволяют определить окислительные и восстановительные свойства металлов и соединений, что является важным шагом в изучении химических процессов и применении металлов в различных областях деятельности.
Окислительно-восстановительные реакции металлов в научных исследованиях
Окислительно-восстановительные реакции металлов являются важным предметом изучения в научных исследованиях. Эти реакции играют ключевую роль в многих процессах, таких как коррозия металлов, электрохимические реакции и каталитические процессы.
В научных исследованиях окислительно-восстановительные реакции металлов часто используются для определения активности и электрохимических свойств металлов. Например, электрохимическое осаждение металла может быть использовано для изучения его электрокаталитической активности в различных реакциях. Это позволяет исследователям определить эффективность металла в качестве катализатора.
Другой важной областью исследований является коррозия металлов. Использование окислительно-восстановительных реакций позволяет изучать механизмы коррозии и разработать методы для предотвращения или замедления этого процесса. Например, изучение реакций окисления и восстановления металлов в присутствии различных окружающих сред позволяет определить, какие факторы способствуют коррозии и какие методы защиты могут быть наиболее эффективными.
Окислительно-восстановительные реакции металлов также используются в качестве основы для разработки новых материалов и технологий. Исследования в этой области позволяют определить, какие металлы и соединения способны обладать высокой электрохимической активностью, что может привести к разработке новых эффективных батарей, солнечных элементов и других электрохимических устройств.
Вопрос-ответ

Какие металлы могут участвовать в окислительно-восстановительных реакциях?
В окислительно-восстановительных реакциях могут участвовать различные металлы, такие как железо, алюминий, цинк, медь и другие.
Какие окислительно-восстановительные реакции могут происходить с железом?
Окислительно-восстановительные реакции с железом могут включать его окисление до двух степеней окисления: Fe^2+ и Fe^3+. Например, реакция Fe + CuSO4 = FeSO4 + Cu, где железо окисляется до степени окисления +2, а медь восстанавливается.
В каких условиях может происходить окисление алюминия?
Окисление алюминия может происходить в кислотной среде, например, в реакции с соляной кислотой: 2Al + 6HCl = 2AlCl3 + 3H2. Также алюминий может окисляться при взаимодействии с кислородом воздуха, образуя покрытие оксида алюминия.
Какие окислительно-восстановительные реакции могут происходить с цинком?
Окислительно-восстановительные реакции с цинком могут включать его окисление до степени окисления +2. Например, реакция Zn + CuSO4 = ZnSO4 + Cu, где цинк окисляется до степени окисления +2, а медь восстанавливается.
Могут ли металлы участвовать в окислительно-восстановительных реакциях с водой?
Да, некоторые металлы могут участвовать в окислительно-восстановительных реакциях с водой. Например, реакция меди с водой: 2Cu + 2H2O = Cu(OH)2 + H2. В этой реакции медь окисляется, образуя гидроксид меди, а вода восстанавливается, превращаясь в молекулы водорода.
