Взаимодействие металлов является одним из важных процессов в химии. Окисление металлов оксидами других металлов – один из типов такого взаимодействия. Оксиды металлов обладают высокой электроотрицательностью и способны проводить электрический ток, поэтому они активно взаимодействуют с металлическими поверхностями.
Процесс окисления металлов оксидами других металлов может протекать как в атмосфере, так и в растворах. В результате окисления металлической поверхности образуются металлические катионы и оксиды металлов. Этот процесс может сопровождаться изменением цвета материала, образованием пленки на поверхности и изменением его механических свойств.
Взаимодействие металлов с оксидами других металлов играет важную роль в различных сферах науки и промышленности. Оно применяется в процессе коррозии металлов, электрохимических реакциях, а также в производстве различных материалов и изделий.
Оксиды металлов обладают различными свойствами и химическими формулами, что определяет их влияние на металлическую поверхность. Например, некоторые оксиды имеют кислотные свойства и могут вызывать коррозию металла, другие обладают щелочными свойствами и способны защитить металл от окисления.
Изучение взаимодействия металлов с оксидами других металлов позволяет понять причины коррозии, разработать способы защиты металлов и создать новые материалы с уникальными свойствами. Этот процесс продолжает быть предметом научных исследований и открывает новые перспективы в области материаловедения и химической промышленности.
Взаимодействие металлов

Взаимодействие металлов – это процесс, при котором металлы вступают в химическую реакцию друг с другом. При таком взаимодействии металлы могут обмениваться электронами, образуя ионы и соединения.
Одно из наиболее известных взаимодействий металлов - окисление металлов оксидами других металлов. При окислении металлы переходят из одного состояния окисления в другое и образуют оксиды. Например, железо при взаимодействии с кислородом образует окись железа (Fe2O3) – ржавчину.
Взаимодействие металлов может происходить и в более сложных ситуациях. Например, при контакте различных металлов в присутствии электролита (раствора солей) может произойти гальваническая коррозия металлов. В этом процессе один металл служит анодом и окисляется, а другой металл служит катодом и восстанавливается. Такой процесс может привести к разрушению материала, поэтому важно знать электрохимические свойства металлов и проводить правильную выборку в паре металлов.
Металлы и их оксиды

Оксиды металлов являются химическими соединениями, состоящими из металла и кислорода. Они образуются в результате окисления металлов при взаимодействии с кислородом. Оксиды металлов имеют различные физические и химические свойства, которые зависят от состава и структуры соединений.
Металлы могут образовывать различные оксиды, включая двухвалентные и трехвалентные. Двухвалентные оксиды формируются при взаимодействии металлов с кислородом в соотношении 1:1, например, оксид железа (FeO). Трехвалентные оксиды образуются при соотношении металла и кислорода 1:1.5, например, оксид алюминия (Al2O3).
Оксиды металлов могут иметь различные степени окисления металла. Например, в оксиде железа (FeO) железо имеет степень окисления +2, а в оксиде железа (Fe2O3) - +3. Это связано с тем, что металл может образовывать соединения с различными количествами кислорода.
Металлы и их оксиды имеют важное значение в различных областях, таких как металлургия, химическая промышленность, электротехника и др. Оксиды металлов используются как катализаторы, пигменты, материалы для производства керамики и стекла, а также в процессах окрашивания и защиты поверхностей металлов от коррозии.
Список оксидов металлов включает множество соединений с различными свойствами и применениями. Некоторые из них - оксид алюминия (Al2O3), оксид кальция (CaO), оксид железа (FeO, Fe2O3), оксид меди (CuO), оксид цинка (ZnO) и др. Каждый из этих оксидов имеет свои особенности и может играть важную роль в различных процессах и промышленных приложениях.
Окисление металлов оксидами

Окисление металлов оксидами – это процесс, при котором металл реагирует с оксидом другого металла, образуя новый оксид. В результате окисления металла его атомы теряют электроны и становятся положительно заряженными ионами, а оксид другого металла получает электроны и превращается в ион с отрицательной зарядом.
Окисление металлов оксидами является одним из основных способов получения металлических оксидов. Данный процесс широко применяется в промышленности для производства химических соединений, например, для получения гальванического покрытия металлом на поверхности другого металла.
Оксиды, полученные в результате окисления металлов, обладают различными свойствами и могут использоваться в разных сферах. Некоторые оксиды металлов имеют кислотные свойства, что позволяет использовать их в качестве катализаторов, в производстве красителей или промышленных кислот. Другие оксиды обладают щелочными свойствами и могут использоваться в производстве стекла, эмалей или в пищевой промышленности.
- Примером окисления металлов оксидами может служить реакция алюминия с кислородом:
| 4Al + 3O2 → 2Al2O3 |
В данной реакции алюминий окисляется до оксида алюминия. Образующийся оксид алюминия имеет высокую термическую стабильность и используется в производстве керамики, а также в строительстве и авиационной промышленности.
Таким образом, окисление металлов оксидами играет важную роль в различных отраслях промышленности и позволяет получать разнообразные химические соединения.
Электрохимические реакции

Электрохимические реакции являются одним из важных аспектов взаимодействия металлов. Они связаны с передачей электронов от одного вещества к другому. Такие реакции происходят при окислении и восстановлении металлов, а также при образовании оксидов металлов.
В электрохимических реакциях каждое вещество выполняет определенную роль. Вещество, отдавая электроны, считается окислителем, а вещество, принимающее электроны, — восстановителем. Окислитель и восстановитель образуют пару окислитель-восстановитель.
Электрохимические реакции происходят при наличии электролита — раствора, способного проводить электрический ток. Электролиты могут быть как жидкими, так и твердыми веществами.
В электрохимических реакциях могут принимать участие различные металлы. Они могут выступать как окислителями, так и восстановителями. При этом основным фактором, определяющим возможность электрохимической реакции, является потенциал восстановления металла. Металлы с более низким потенциалом восстановления выступают в реакции в качестве окислителей, а металлы с более высоким потенциалом — в качестве восстановителей.
Влияние оксидов на свойства металлов
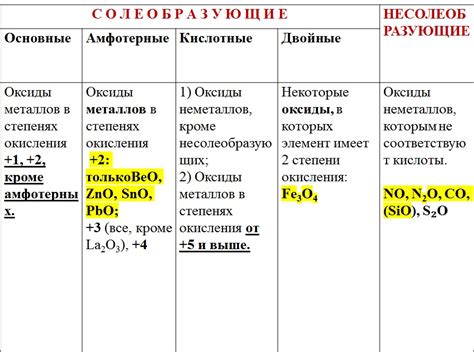
Оксиды других металлов могут оказывать значительное влияние на свойства металлов, с которыми они взаимодействуют. Это связано с тем, что оксиды металлов обладают специфическими физическими и химическими свойствами, которые передаются металлам в процессе окисления.
Во-первых, оксиды металлов могут изменять электропроводность металлов. Некоторые оксиды, такие как оксид железа или оксид меди, обладают полупроводниковыми свойствами и могут влиять на электрическую проводимость металлов. Это может привести к изменению электрических свойств металла и его способности проводить электрический ток.
Во-вторых, оксиды металлов могут изменять механические свойства металлов. Некоторые оксиды, например оксид алюминия или оксид титана, обладают высокой твердостью и могут усиливать металлическую матрицу. Также некоторые оксиды могут снижать пластичность и ударную вязкость металлов, что может быть важным при проектировании конструкций из металла.
Наконец, оксиды металлов могут влиять на химическую стойкость металлов. Некоторые оксиды, например оксид алюминия или оксид цинка, обладают высокой устойчивостью к различным воздействиям, таким как окисление, коррозия или воздействие кислотных и щелочных сред. Поэтому покрытия из таких оксидов могут использоваться для защиты металлов от разрушения и повреждений.
Вопрос-ответ

Как происходит взаимодействие металлов при окислении оксидами других металлов?
При взаимодействии металлов с оксидами других металлов происходит процесс окисления, при котором металл переходит в окисленное состояние, а оксид металла, с которым он взаимодействует, редуцируется.
Какие реакции происходят при окислении металлов оксидами других металлов?
При окислении металлов оксидами других металлов происходят реакции окисления-восстановления. Металл окисляется, принимая электроны от оксида металла, и при этом оксид металла восстанавливается, отдавая электроны.
