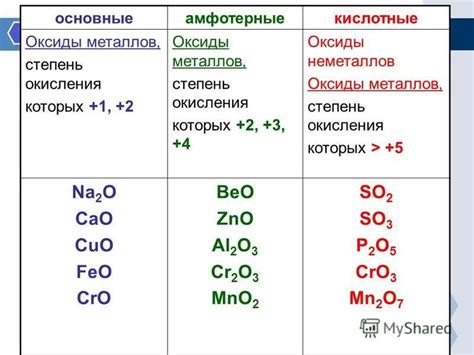
Окисление металлов является важным процессом в химии и находит широкое применение в различных областях. Одним из таких металлов является железо (Fe), которое встречается в природе в различных окисленных формах. Одной из самых распространенных окисленных форм железа является оксид железа, известный как FeO.
Степень окисления металла определяет его химические и физические свойства. В случае FeO, железо имеет степень окисления +2, что означает, что оно потеряло два электрона. Такое состояние металла делает FeO одним из самых стабильных окислов железа.
FeO обладает рядом особенностей и свойств, которые делают его полезным в различных областях. Он является твёрдым, одноимённым веществом со светло-зелёным цветом. Благодаря своей стабильности, FeO применяется в качестве катализатора при реакциях окисления органических соединений, а также в процессах производства керамики, стекла и стали.
Оксид железа FeO также обладает магнитными свойствами и используется в магнитной электронике и медицине. Более того, FeO может быть применен в процессах синтеза полимерных материалов и лакокрасочных покрытий.
В заключение, степень окисления металла FeO и его свойства являются важными аспектами, определяющими его применение в различных отраслях. FeO обладает стабильностью и разнообразными физико-химическими свойствами, что делает его ценным материалом в производстве различных продуктов, от электроники и керамики до стали и лакокрасочных покрытий.
Свойства и степень окисления металла FeO
FeO - это оксид железа, состоящий из одного атома железа и одного атома кислорода. Этот соединение имеет важные свойства и играет важную роль в химических реакциях и промышленных процессах.
Степень окисления металла Fe в FeO составляет +2. Это значит, что металл отдал два электрона, образуя положительный ион Fe2+.
FeO является кристаллическим веществом, обладающим бледно-зеленоватым цветом. Оно образует моноклинную решетку, в которой ионы железа и кислорода располагаются последовательно друг за другом.
Одно из основных свойств FeO - его возможность вступать в реакции с кислородом. При повторном окислении FeO образуется оксид железа(III) Fe2O3.
- FeO является основой и может взаимодействовать с кислотами, образуя соль и воду.
- Оно обладает свойством амфотерности - может реагировать и с кислотами, и с щелочами.
- FeO обладает свойством магнитности, поэтому его часто используют в магнитных материалах и устройствах.
FeO также применяется в медицине и фармацевтике. Оно используется как источник железа, необходимого для образования гемоглобина в крови. Кроме того, FeO может быть использовано в качестве пигмента для красок и косметических продуктов.
Таким образом, металл Fe в соединении FeO обладает определенной степенью окисления и имеет разнообразные свойства, которые широко используются в различных сферах науки и промышленности.
Состав вещества и его физические свойства

Металлическое соединение FeO представляет собой оксид железа(II) или железную оксидную связь, в которой железо имеет степень окисления +2.
Состав: Вещество состоит из ионов железа(II) Fe2+ и кислородных ионов O2-. Отношение между атомами железа и кислорода в соединении равно 1:1.
Физические свойства:
- Цвет: FeO обладает чёрным цветом, что связано с абсорбцией света всех видимых частот спектра.
- Твердость: Соединение является твёрдым и хрупким, с малой пластичностью и упругостью. Однако, эти свойства могут изменяться в зависимости от условий синтеза.
- Плотность и плотность плавления: Плотность оксида железа(II) составляет около 5,7 г/см³. Точка плавления FeO находится при температуре около 1369 °C.
- Растворимость: FeO плохо растворим в воде и растворах кислоты и щелочи, он образует нерастворимое вещество, так как является основанием слабой кислоты.
- Магнитные свойства: Соединение обладает магнитными свойствами и является ферромагнетиком, то есть проявляет магнитизм в присутствии внешнего магнитного поля.
Химические свойства металла FeO

Металл FeO (оксид железа(II)) обладает рядом химических свойств, которые определяют его реакционную способность и влияют на его использование в различных областях.
1. Окислительные свойства: FeO является окислителем, способным взаимодействовать с другими веществами, отдавая свой электрон. В результате FeO сам восстанавливается, превращаясь в другие соединения.
2. Реакция со взаимодействием с водой: При взаимодействии FeO с водой образуется гидроксид железа(II) (Fe(OH)2), который затем может реагировать дальше с воздухом, окисляясь и превращаясь в гидроксид железа(III) (Fe(OH)3).
3. Реакция с кислотами: FeO может реагировать с кислотами, образуя соли железа(II) и выделяя водород. В этой реакции FeO действует в качестве основания, принимая один протон от кислоты.
4. Реакция с галогенами: FeO реагирует с галогенами (например, хлором, бромом), образуя соответствующие галогениды железа(II). В ходе реакции происходит обмен ионами.
5. Взаимодействие с кислородом: FeO может реагировать с кислородом, окисляясь и превращаясь в оксид железа(III) (Fe2O3). При этом происходит образование ржавчины.
6. Реакция с серной кислотой: FeO может реагировать с серной кислотой, образуя соль железа(II) и выделяя сернистый газ (SO2). В результате FeO окисляется.
Такие свойства металла FeO определяют его применение в различных областях, включая производство стали, производство химических веществ, процессы очистки воды и многое другое.
Применение металла FeO в промышленности

Металл FeO, или оксид железа(II), широко применяется в различных отраслях промышленности благодаря своим уникальным свойствам.
1. Производство стали: FeO является важным компонентом при производстве стали. Он используется как сплавующий агент, помогая снизить температуру плавления стали и повысить ее прочность. Благодаря взаимодействию с другими компонентами сплава, металл FeO способен придать стали необходимые свойства, такие как повышенная твердость и устойчивость к коррозии.
2. Производство магнитных материалов: Металл FeO является важным компонентом при производстве магнитных материалов, таких как магниты и магнитные бумаги. Благодаря своим магнитным свойствам, он позволяет создавать материалы с высокой магнитной индукцией и стабильностью, что делает их идеальными для использования в различных электронных устройствах и считывающих устройствах.
3. Производство красок и пигментов: FeO используется для производства различных видов красок и пигментов благодаря своему способности образовывать интенсивные и стойкие красящие соединения. Он активно применяется в производстве красок для окрашивания металлических поверхностей, а также в производстве косметики и текстильных материалов.
4. Производство стекла: Оксид железа(II) также применяется в производстве стекла. Он играет роль стеклообразующего вещества, обеспечивая механическую прочность и стабильность стекла. Благодаря своим светопропускным свойствам, металл FeO позволяет создавать стекло различных оттенков и тонов, что находит применение в производстве оконных стекол, посуды и декоративных изделий.
5. Производство удобрений: FeO используется в производстве удобрений для повышения плодородия почвы. Он представляет собой ценный источник железа для растений, необходимого для их нормального развития и роста. Удобрения на основе FeO способствуют улучшению качества почвы, повышению урожайности и преодолению дефицита железа у растений.
В целом, металл FeO является востребованным и многофункциональным материалом в промышленности, благодаря своим уникальным свойствам и широкому спектру применения в различных отраслях.
Окружающая среда и экологические аспекты использования металла FeO

Металл FeO, или железо(II) оксид, является одним из наиболее распространенных оксидов железа в природе. В окружающей среде FeO можно встретить в виде различных минералов, таких как гематит, магнетит и марганцевая железняк. Производство и использование FeO имеет не только положительные, но и отрицательные экологические аспекты.
Одним из положительных аспектов использования металла FeO является его широкое применение в производстве стали. FeO используется как добавка для увеличения содержания железа в стали и улучшения ее свойств. Это позволяет снизить потребность в добыче и переработке железной руды, что снижает негативное влияние на окружающую среду.
Однако, использование FeO также может иметь отрицательные экологические последствия. В процессе производства стали с применением FeO выделяются значительные объемы парниковых газов, таких как оксиды углерода и диоксид серы. Эти газы являются причиной загрязнения атмосферы и воздействуют на климат, способствуя глобальному потеплению.
Кроме того, при обращении с отходами, содержащими FeO, необходимо учитывать их потенциальную опасность для окружающей среды. Отходы, содержащие FeO, могут содержать тяжелые металлы и другие токсичные вещества, которые могут попадать в почву и воду и наносить ущерб экосистемам.
Для уменьшения негативного влияния использования металла FeO на окружающую среду необходимо применять современные технологии производства, основанные на эффективном использовании энергии и ресурсов, а также на максимальной утилизации отходов. Также важно регулировать выбросы парниковых газов и контролировать обращение с отходами, содержащими FeO, для минимизации негативных экологических последствий.
Вопрос-ответ

Какова степень окисления металла FeO?
Степень окисления металла FeO равна +2.
Какими свойствами обладает металл FeO?
Металл FeO обладает свойствами магнетизма, проводимости электричества и тепла. Он также является твердым материалом, имеет черный цвет и хорошо растворим в кислотах.
Что происходит с металлом FeO при окислении?
При окислении металла FeO происходит образование оксида железа(III) Fe2O3.
