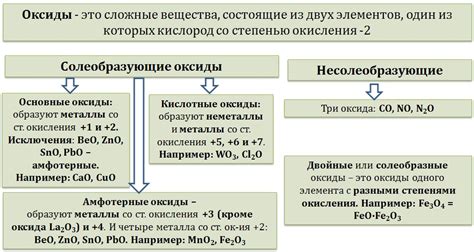
Оксиды железа – это класс соединений, состоящих из атомов железа и кислорода. Одним из наиболее известных оксидов железа является соединение Fe2O3, также известное как трехокись железа или гематит. Этот оксид обладает важными физическими и химическими свойствами, которые делают его полезным в различных областях.
Структура Fe2O3 представляет собой кристаллическую решетку, в которой атомы железа связаны с атомами кислорода. Это соединение обладает высокой степенью устойчивости и является нечувствительным к воздействию влаги и кислот. Благодаря своей структуре, трехокись железа обладает высокой термической стабильностью и способностью переносить высокие температуры.
Fe2O3 имеет широкое применение в различных отраслях науки и промышленности. В первую очередь, это соединение используется в производстве стали и других металлов. Трехокись железа также является важным компонентом в катализаторах и ферромагнитных материалах. Оксид Fe2O3 используется в качестве пигмента для окрашивания стекла, керамики и косметических продуктов.
Трехокись железа имеет также интересные свойства в биологии и медицине. В некоторых случаях наночастицы Fe2O3 могут быть использованы для доставки лекарственных препаратов к определенным участкам организма. Это связано с их магнитными свойствами и возможностью контролировать их движение с помощью магнитного поля.
Оксиды железа: особенности и свойства
Оксиды железа – это класс химических соединений, которые содержат атомы железа и атомы кислорода. В данной статье рассмотрим одно из наиболее распространенных ортооксидов – Fe2O3, или оксид железа(III).
Оксид железа(III) обладает несколькими особенностями и свойствами:
- Цвет и структура. Оксид железа(III) обладает красновато-коричневым цветом, который обусловлен его кристаллической структурой. Вещество имеет жесткую сетчатую структуру с высокой плотностью и высокой точкой плавления.
- Магнитные свойства. Оксид железа(III) является антиферромагнетиком – его магнитные свойства проявляются при низких температурах. При повышении температуры оксид железа(III) становится парамагнитным.
- Химическая активность. Оксид железа(III) реагирует с кислородом, образуя при этом более высоковалентные оксиды. Он также образует соли с кислотами и базами.
- Применения. Оксид железа(III) широко применяется в различных областях. Например, его используют в производстве красок, пигментов, косметических средств. Он также применяется в электронике и катализаторах.
- Токсичность. Оксид железа(III) считается относительно безопасным соединением. Однако, при попадании в организм в больших количествах, он может вызывать раздражение кожи и слизистых оболочек.
Оксиды железа являются важными соединениями, которые находят применение в различных областях науки и промышленности. Изучение их свойств и особенностей позволяет расширить наше понимание химических процессов и использовать эти соединения в различных сферах деятельности.
Соединение Fe2O3: состав и структура
Соединение Fe2O3 представляет собой оксид железа(III), состоящий из двух атомов железа и трех атомов кислорода. Это трехкратное оксидное соединение, в котором каждый атом железа имеет тривалентность, то есть, у него три свободных электрона во внешней электронной оболочке.
Структура соединения Fe2O3 является сложной и состоит из ионов Fe3+ и O2-. Ионы железа образуют слои, а ионы кислорода располагаются между ними. Эти слои соединены с помощью кислородных и атомных мостов, образуя трехмерную решетку.
Высокая степень оксидации у железа в Fe2O3 обусловлена тем, что каждый атом железа в данном соединении связан с тремя атомами кислорода. Это обеспечивает стабильность данного соединения и его способность к образованию ионных связей.
В природе соединение Fe2O3 встречается в виде минерала гематита, который имеет красно-коричневый цвет и является одним из самых распространенных минералов железа. Гематит обладает хорошей устойчивостью и встречается в различных геологических образованиях, таких как алмазы и радиолариты.
Физические свойства оксида железа Fe2O3

Оксид железа Fe2O3, также известный как гематит, является одним из основных оксидов железа. Он представляет собой твёрдое вещество, которое обладает хорошей стойкостью к высоким температурам и окружающей среде.
Цвет гематита может варьироваться от красного до тёмно-красного, в зависимости от степени его чистоты. Он имеет металлический блеск и обладает неправильной формой кристаллов.
Плотность оксида железа Fe2O3 составляет около 5,24 г/см³, что делает его довольно плотным веществом. Он также обладает хрупкостью и твёрдостью в диапазоне 5,5-6,5 по шкале Мооса, что делает его достаточно прочным материалом.
Растворимость гематита в воде крайне низкая. Существует взаимодействие между оксидом железа Fe2O3 и водой, при котором образуется гидроксид железа, что делает его малорастворимым в водных средах.
Температура плавления оксида железа Fe2O3 составляет около 1565 °C, что делает его стойким к высоким температурам и позволяет использовать его в различных производственных процессах, связанных с нагреванием до высоких температур.
Электропроводность гематита является низкой, так как он является изолятором. Это связано с его кристаллической структурой и низкой подвижностью носителей заряда внутри материала.
Химические свойства и реакции с участием Fe2O3
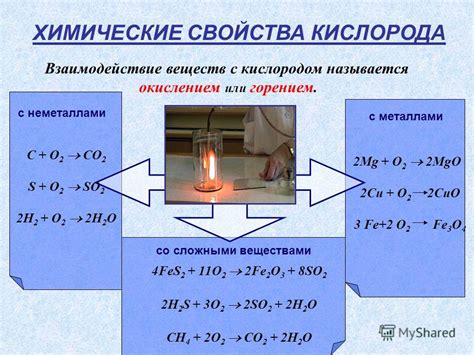
Оксид железа(III) (Fe2O3), также известный как гематит, является одним из самых распространенных оксидов железа. Он обладает рядом химических свойств, которые делают его полезным в различных реакциях и процессах.
У Fe2O3 есть высокая степень устойчивости и сохраняет свою кристаллическую структуру при высоких температурах. Однако, при нагревании до 1565 °C Fe2O3 подвергается разложению на железо и кислород. Это можно использовать для получения чистого железа в процессе пирометаллургии.
Fe2O3 также действует как оксидант во многих реакциях. Он может окислять другие соединения, передавая им электроны и сам тем самым восстанавливаясь. Например, при взаимодействии с металлическим алюминием (Al), Fe2O3 окисляет алюминий до оксида алюминия (Al2O3), одновременно само восстанавливаясь до железа (Fe).
Также стоит отметить, что в присутствии оксида углерода(II) (CO), Fe2O3 может претерпевать реакцию газовой фазы со смешением и превращаться в Fe3O4, известный как магнетит. Эта реакция используется в процессе поглощения оксидов углерода в металлургической промышленности.
Оксид железа(III) также способен реагировать с водой. В результате этой реакции образуется щелочное растворение железа с образованием очень слабого раствора гидроксида железа(III), что может быть полезно в различных приложениях.
В целом, химические свойства Fe2O3 позволяют использовать его в широком спектре реакций и процессов, от пирометаллургии до металлургической промышленности, делая его важным соединением в области химии и материаловедения.
Вопрос-ответ

Какие свойства имеет соединение Fe2O3?
Соединение Fe2O3, или трехатомный оксид железа, обладает следующими свойствами: твердое вещество красного цвета, нерастворимое в воде и слабых кислотах, химически инертное при нормальных условиях, образует стабильную кристаллическую решетку.
В каких областях применяется Fe2O3?
Fe2O3 применяется в различных областях, включая производство стекла, керамики, красок и пигментов, магнитных материалов, катализаторов и многих других. Также трехатомный оксид железа используется в медицине и косметике.
В чем заключается особенность трехатомного оксида железа?
Особенностью трехатомного оксида железа является его способность образовывать прочное соединение с кислородом и железом. Благодаря этому, Fe2O3 обладает высокой химической стойкостью и стабильностью, что делает его полезным во многих областях применения.
Какое значение имеет трехатомный оксид железа для человека?
Для человека трехатомный оксид железа имеет значение в медицине, где он используется в качестве противоанемического средства. Также Fe2O3 может использоваться в косметике как краситель.
Какова структура трехатомного оксида железа?
Структура трехатомного оксида железа представляет собой кристаллическую решетку, состоящую из оксидных и железных ионов. Оксидные ионы окружают железные ионы, образуя компактную структуру. Эта структура обеспечивает химическую стойкость и стабильность соединения.
