Металлы - это элементы, обладающие специфическими физическими и химическими свойствами, которые их отличают от других типов веществ. Они являются одной из основных групп элементов периодической системы и включают в себя такие металлы, как железо, алюминий, медь и золото.
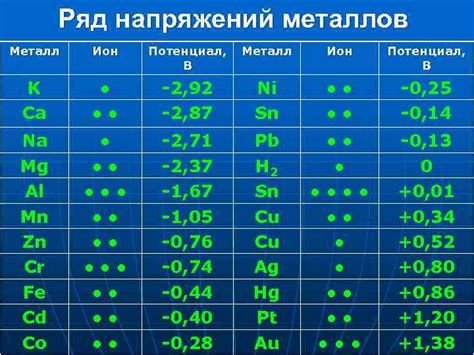
Одно из главных химических свойств металлов - их способность образовывать ион положительного заряда. Это связано с тем, что у металлов внешние электроны легко отдаются. В результате, они образуют катионы - положительно заряженные ионы, которые способны участвовать в различных химических реакциях.
Еще одно химическое свойство металлов - их способность образовывать сплавы. Сплавы представляют собой материалы, состоящие из двух или более металлов, которые обладают общими физическими и химическими свойствами. Благодаря этому свойству, металлы широко применяются в промышленности, особенно в производстве металлических конструкций и различных предметов повседневного использования.
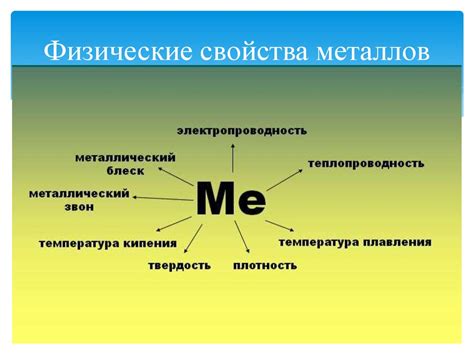
Кроме того, металлы обладают высокой электропроводностью и теплопроводностью. Это связано с их способностью свободно передвигаться по кристаллической решетке металла и переносить электроны или тепловую энергию. Это является важным физическим свойством металлов, благодаря которому они широко применяются в проводниках электрического тока и в теплообменных устройствах, таких как радиаторы и теплообменники.
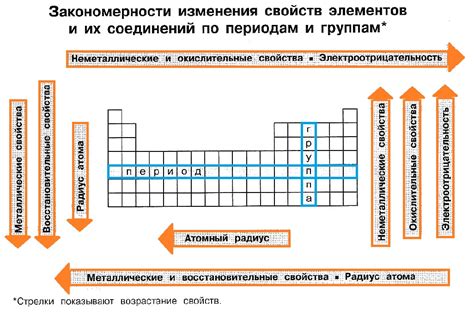
Химические свойства металлов

Металлы – это элементы, обладающие рядом характерных химических свойств. Одной из наиболее известных особенностей металлов является их способность образовывать ионы положительного заряда.
Металлы обладают высокой теплопроводностью и электропроводностью, что связано с наличием свободных электронов в их кристаллической решетке. Именно благодаря этому свойству металлы широко используются в производстве проводников, электрических приборов и других устройств.
Окисление – еще одно важное химическое свойство металлов. Они активно соединяются с кислородом и образуют оксиды. Некоторые металлы, такие как железо и алюминий, способны образовывать покрытие оксидной пленки на поверхности при взаимодействии с кислородом влажного воздуха. Это покрытие обладает защитными свойствами, предотвращая дальнейшую коррозию металла.
Еще одним важным химическим свойством металлов является их реактивность. Некоторые металлы, такие как натрий и калий, реагируют с водой, образуя соответствующие гидроксиды и выделяя водород. Другие металлы, такие как свинец и золото, практически не реагируют с водой и сохраняют свои химические свойства.
Металлы также способны образовывать соли с кислотами. Реакция металла с кислотой приводит к образованию соответствующего солевого соединения и выделению водорода. Этим свойством активно пользуются в лабораторных и промышленных процессах, где важно образование солей металлов.
Реакция с водой

Многие металлы проявляют активность при контакте с водой, что обусловлено их способностью образовывать гидроксиды или водород. Реакция с водой свойственна различным группам металлов и может протекать по-разному в зависимости от их положения в периодической системе.
Алкалий и некоторые щелочноземельные металлы, такие как натрий, калий и кальций, очень ярко проявляют свою активность в реакции с водой. При контакте с водой они быстро реагируют, образуя гидроксид и выделяя водород. Данная реакция сопровождается образованием пузырьков газа и химическими изменениями, такими как нагревание раствора и изменение его pH.
Также с водой взаимодействуют металлы из группы алюминия и цинка. Они образуют гидроксиды и выделяют небольшое количество водорода при взаимодействии с водой. Реакция данных металлов с водой протекает медленнее, чем у алкалийных и щелочноземельных металлов, однако они все равно являются активными.
Некоторые металлы не реагируют с водой. К ним относятся железо, свинец, медь и платина. Значит, они не образуют с водой гидроксиды и не выделяют водород. Такие металлы обладают низкой активностью и потому реакция с водой у них не наблюдается.
Окислительно-восстановительные свойства

Металлы обладают широким спектром окислительно-восстановительных свойств, что делает их важными соединительными элементами множества реакций. Они могут образовывать ионы, способные к окислению, а также принимать дополнительные электроны, проявляя восстановительные свойства.
Эти свойства объясняются электронной структурой металлов. Внешние электроны в металлах легко отделяются, образуя положительно заряженные ионы, способные при взаимодействии с другими соединениями принимать на себя дополнительные электроны. Такие реакции обычно сопровождаются изменением окислительного состояния металла.
Одним из примеров окислительно-восстановительных свойств металлов является их реакция с кислородом. Некоторые металлы, такие как магний и алюминий, при взаимодействии с кислородом образуют оксиды – соединения, в которых металл обладает более высоким окислительным состоянием.
Другим примером является реакция металлов с водой. Некоторые металлы, такие как натрий и калий, при контакте с водой активно реагируют, образуя гидроксиды и выделяя водород. При этом металл вступает в реакцию с водой, окисляясь до более высокого окислительного состояния.
Реакция с кислородом

Металлы обладают высокой активностью в реакции с кислородом.
При нагревании металлы соединяются с кислородом, образуя оксиды металлов. Например, медь при сильном нагревании соединяется с кислородом из воздуха и образует красную оксид меди (Cu2O), который имеет кубическую кристаллическую структуру.
Некоторые металлы, такие как магний и алюминий, образуют более стабильные оксиды при воздействии кислорода. Например, магний сгорает в кислороде, образуя белый оксид магния (MgO), который обладает высокой теплоустойчивостью.
Реакция металлов с кислородом может происходить и в растворах. Например, одной из наиболее известных реакций является реакция магния с водой, при которой магний образует оксид магния и высвобождается водородный газ.
Важно отметить, что реактивность металлов в реакции с кислородом может зависеть от их плотности, структуры и химической активности. Например, щелочные металлы (натрий, калий) легко реагируют с кислородом, в то время как некоторые переходные металлы (железо, медь) реагируют с кислородом только при нагревании.
Коррозия и стойкость к коррозии

Коррозия является одной из основных проблем, с которыми сталкиваются металлы. Она представляет собой процесс разрушения металлов под воздействием окружающей среды, основными факторами которой являются влага, кислоты, соли и другие химические соединения.
Стойкость к коррозии является важным свойством металлов и определяет их способность противостоять действию разрушающих факторов. Некоторые металлы обладают высокой стойкостью к коррозии, что позволяет им использоваться в самых требовательных условиях, например, при производстве химических реактивов или в морской среде.
Другие металлы могут быть подвержены интенсивной коррозии и требуют особых мер для защиты. Для защиты от коррозии часто применяются такие методы, как покрытие металла защитными покрытиями, использование антикоррозионных добавок или применение специальных сплавов, обладающих стойкостью к коррозии.
Для измерения стойкости к коррозии применяются различные методы, включая испытания в морской среде, контроль электрохимического потенциала и проведение специальных экспериментов на стойкость к коррозии.
Стойкость металлов к коррозии имеет важное значение в различных областях применения, от строительства и авиации до электроники и медицины. Правильный выбор материала с учетом его стойкости к коррозии позволяет обеспечивать длительный срок службы изделий и сохранять их работоспособность.
Реакция с кислотами

Металлы проявляют различную активность при взаимодействии с кислотами. Некоторые металлы, такие как натрий, калий и магний, реагируют с кислотами с выделением водорода. Эта реакция происходит в результате вытеснения водорода из кислоты металлом. Таким образом, при взаимодействии с сильными кислотами, например, соляной или серной, образуется соль и выделяется водородный газ.
Однако не все металлы обладают способностью реагировать с кислотами. К ним относятся металлы из группы платиновых металлов, такие как платина и золото. Эти металлы не реагируют с кислотами, так как они являются химически инертными.
Кроме того, некоторые металлы, например, алюминий и цинк, могут реагировать не только с кислотами, но и с щелочами. При этом происходит образование солей и выделение водорода.
В целом, реакция металлов с кислотами является одним из основных химических свойств металлов. Она позволяет определить активность металла и его способность взаимодействовать с другими веществами. Это свойство находит применение в таких областях, как металлургия, химическая промышленность и лабораторные исследования.
Реакция металлов с щелочами

Реакция металлов с щелочами является одним из основных химических свойств металлов. Под щелочами понимаются гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH).
Многие металлы реагируют с щелочами, образуя гидроксиды и выделяя водород. Например, реакция железа (Fe) с гидроксидом натрия (NaOH) приводит к образованию гидроксида железа (Fe(OH)2) и выделению водорода (H2):
- Fe + 2NaOH → Fe(OH)2 + H2
Некоторые металлы, такие как алюминий (Al) и цинк (Zn), реагируют с щелочами с образованием гидроксидов и выделением гидрогена. Например, реакция алюминия (Al) с гидроксидом калия (KOH) приводит к образованию гидроксида алюминия (Al(OH)3) и выделению водорода (H2):
- 2Al + 6KOH -> 2K3AlO3 + 3H2
Некоторые металлы, например, золото (Au) и платина (Pt), не реагируют с щелочами и остаются стабильными в их присутствии. Это обусловлено высокой химической устойчивостью данных металлов.
Термическое разложение

Термическое разложение — это процесс распада вещества под воздействием повышенной температуры. Металлы также могут претерпевать термическое разложение.
При нагревании металлы могут разлагаться на металлический оксид и свободный кислород, например, окисление железа приводит к образованию ржавчины. Некоторые металлы могут разлагаться на недостаток или избыток кислорода, что зависит от условий нагревания.
Термическое разложение металлов может привести к изменению их химических и физических свойств. Например, при нагревании цинка он начинает испаряться и образует пары, которые имеют взрывоопасные свойства.
Термическое разложение металлов может использоваться в различных отраслях промышленности, например, в металлургии для получения чистого металла из его руды или в химической промышленности для получения оксидов металлов.
Способы получения металлов
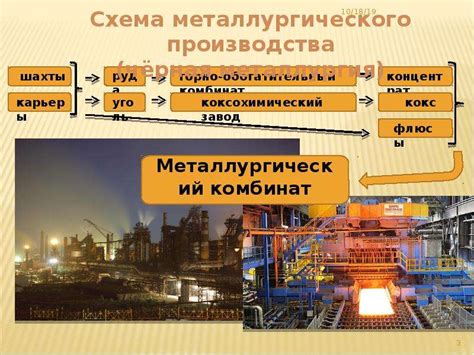
Металлы – это химические элементы, обладающие способностью проводить электричество и тепло. Они являются основными строительными блоками различных материалов, используемых в промышленности и повседневной жизни человека. Получение металлов – важный промышленный процесс, осуществляемый различными методами.
Одним из способов получения металлов является горячая обработка руды. При этом руда, содержащая металлы, подвергается высокой температуре, что приводит к их плавлению и отделению от других компонентов. Такой способ получения используется для получения железа, цветных металлов и других металлов, выделяемых в виде сплавов.
Другим распространенным способом получения металлов является электролиз – процесс разложения вещества под действием постоянного электрического тока. При этом металлы осаждается на одном из электродов – отрицательно заряженных металлических пластин, а растворенные ионы металла образуют раствор в электролите. Этот метод применяется для получения металлов, таких как никель, цинк, медь и др.
Также металлы можно получить путем химических реакций. Например, взаимодействие металлических оксидов с восстановителем может привести к получению чистого металла. Этот метод используется для получения алюминия, железа и некоторых других металлов.
Современные методы получения металлов также включают использование специальных технологий, таких как лазерная обработка, плазменная обработка и многие другие. Они позволяют получать высококачественные металлические изделия с определенными свойствами и характеристиками.
Вопрос-ответ

Какие основные свойства металлов?
Основные свойства металлов – высокая теплопроводность, электропроводность, пластичность и металлический блеск.
Что такое теплопроводность металлов?
Теплопроводность металлов – это способность металлов проводить тепло при заданном градиенте температуры. Металлы обладают высокой теплопроводностью благодаря свободно движущимся электронам в их структуре.
Что такое электропроводность металлов?
Электропроводность металлов – это способность металлов проводить электрический ток. Металлы обладают высокой электропроводностью из-за наличия свободно движущихся электронов в их структуре.
Почему металлы обладают пластичностью?
Металлы обладают пластичностью из-за способности их атомов смещаться друг относительно друга без разрушения кристаллической структуры. Это свойство позволяет металлам быть легко поддающимися деформации и обработке.