Металл натрий (Na) - это химический элемент из группы алкалиевых металлов, который обладает рядом уникальных особенностей. Натрий является активным металлом и хорошим проводником электричества и тепла.
Одной из наиболее интересных химических особенностей натрия является его реакция с водой. Когда натрий контактирует с водой, происходит сильное шипение и выделение водорода. Это вызвано реакцией натрия с водой, при которой образуется гидроксид натрия и высвобождается молекулярный водород. Также натрий способен реагировать с кислородом, образуя оксид натрия.
Натрий широко используется в различных областях, включая производство щелочей, стекла, сода, пластмасс и алюминия. Он также является важным компонентом пищевых добавок, таких как поваренная соль. Натрий также играет роль в регуляции баланса жидкостей в организме и нервной передаче сигналов.
Химические свойства натрия

Натрий - один из самых распространенных элементов в земной коре. Он принадлежит к группе щелочных металлов и имеет атомный номер 11.
У натрия высокая химическая активность, что обусловлено его строением электронной оболочки. У натрия всего одна электронная оболочка, которая включает в себя один электрон. Из-за этого натрий стремится отдать этот электрон, чтобы достигнуть стабильной электронной конфигурации.
Натрий очень реактивен и легко реагирует с кислородом, водой, хлором и другими элементами. При взаимодействии с водой натрий образует щелочные растворы. Он растворяется в воде с выделением водорода и образованием гидроксида натрия.
Натрий реагирует с кислородом воздуха, образуя оксид натрия, который обладает сильно щелочными свойствами.
Натрий также образует соединения с другими элементами, такие как хлор, сера, фосфор и многие другие. Натрий хорошо растворяется в металлах и сплавах, таких как алюминий и железо.
Натрий является важным элементом для жизни. Он необходим для правильного функционирования нашего организма, участвует в регуляции баланса воды и электролитов, а также в работе нервной системы. Натрий содержится во многих продуктах питания, таких как морская соль, сыры, молоко, мясо, овощи и фрукты.
Атомная структура натрия
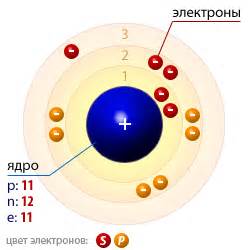
Натрий (Na) - химический элемент, атомный номер которого равен 11. Он относится к группе алкалийных металлов в периодической системе химических элементов. Натрий обладает уникальной атомной структурой, которая определяет его особенности и свойства.
Атом натрия состоит из ядра, в котором находятся 11 протонов и обычно также 12 нейтронов. Вокруг ядра располагаются электроны, занимающие определенные энергетические уровни или оболочки. У натрия есть две электронные оболочки: первая оболочка может вместить до 2 электронов, а вторая оболочка - до 8 электронов.
Поэтому, электронная конфигурация натрия можно записать как 2, 8, 1, где 2 - количество электронов в первой оболочке, 8 - количество электронов во второй оболочке и 1 - количество электронов в третьей оболочке.
Такая атомная структура натрия делает его химически активным, так как электрон в третьей оболочке является валентным и легко участвует в химических реакциях. Натрий стремится отдать свой валентный электрон, чтобы достичь более стабильной электронной конфигурации аргония (2, 8). Это делает натрий металлом сильно щелочным и реактивным.
Атомная структура натрия имеет важное значение для его свойств и использования в различных областях науки и промышленности. Благодаря своей активности и способности образовывать химические соединения, натрий широко используется в производстве стекла, пищевой промышленности, металлургии и других областях.
Реакция натрия с водой

Реакция натрия с водой является одной из самых известных и показательных химических реакций. Она происходит с выделением газа и образованием щелочи.
Когда натрий погружается в воду, начинается активное химическое взаимодействие. Натрий, обладающий высокой реакционной способностью, прореагирует с молекулами воды и вызовет искры и выделение водорода.
Реакция между натрием и водой является экзотермической и сопровождается выделением значительного количества тепла. Также в результате этой реакции происходит образование гидроксида натрия (NaOH), который является щелочью.
Образовавшаяся щелочь натрия имеет щелочную реакцию и способна интенсивно реагировать с различными кислотами. Она может использоваться в производстве стекла, мыла и других химических соединений.
Взаимодействие натрия с водой является научным явлением, которое может быть наблюдаемо даже в обычных условиях и показывает химическую активность металла натрия.
Химический символ и периодическое место натрия

Натрий – это химический элемент, который обозначается символом Na. Он относится к группе щелочных металлов и занимает 3-ю группу периодической системы Менделеева. Символ Na происходит от немецкого слова "Natrium".
Периодическая система Менделеева представляет собой организацию химических элементов по возрастанию атомных номеров. Натрий находится во 2-й периоде, что означает наличие у него 2 энергетических уровней. В таблице периодических элементов натрий располагается под литием и между элементами магнием и алюминием. Его атомный номер равен 11, что показывает количество протонов в его ядре.
Натрий – металл серебристо-белого цвета, имеющий мягкую консистенцию. Он легко расплавляется и испаряется при недостаточно высоких температурах. Благодаря своей химической активности, натрий реагирует с водой, кислородом воздуха и другими элементами.
- Атомный радиус натрия составляет 186 пикометров.
- Электронная конфигурация натрия: 1s2 2s2 2p6 3s1.
- Натрий имеет высокую проводимость электричества и тепла, поэтому находит широкое применение в различных электротехнических и металлургических процессах.
Натрий легко образует ионы Na+, которые обладают положительным зарядом из-за потери одного внешнего электрона. Это позволяет использовать натрий в реакциях с различными веществами, включая воду, чтобы образовать гидроксид натрия и высвободить водород.
Важно отметить, что натрий является жизненно важным элементом для многих организмов, включая человека. Он участвует в регуляции осмотического давления, поддержании кислотно-щелочного баланса и функционировании мышц и нервной системы.
Взаимодействие натрия с кислородом

Натрий — химический элемент из группы щелочных металлов, обладающий высокой реактивностью. Взаимодействие натрия с кислородом происходит при высоких температурах и может протекать в нескольких формах.
При нагревании натрия до высоких температур, оксид натрия (Na2O) образуется из реакции натрия с кислородом. Это неорганическое соединение представляет собой бесцветные кристаллы, обладающие сильными основными свойствами.
Взаимодействие элементарного натрия с кислородом также может протекать в форме образования пероксида натрия (Na2O2). Этот соединение образуется при недостатке кислорода и представляет собой фасоль или бесцветные кристаллы. Пероксид натрия обладает окислительными свойствами и может использоваться в качестве источника кислорода.
Взаимодействие натрия с озоном (O3) приводит к образованию оксида натрия (Na2O) и кислорода. Это реакция является быстрой и сопровождается выделением тепла и света.
Образование оксида натрия

Оксид натрия (Na2O) является одной из важных химических соединений натрия. Он образуется при реакции натрия с кислородом, которая происходит при высокой температуре.
В процессе образования оксида натрия, натрий активно взаимодействует с кислородом воздуха. При этом образуется белая кристаллическая субстанция. Этот процесс происходит с выделением большого количества тепла.
Оксид натрия можно получить также путем кальцинирования натриевых солей или при пропускании кислорода через раскаленную соду. В обоих случаях образуется сильно гигроскопичное вещество, то есть оно быстро впитывает влагу из окружающей среды.
Кристаллы оксида натрия обладают регулярной кристаллической решеткой и имеют высокую температуру плавления – около 1130 градусов Цельсия. Оксид натрия обладает щелочными свойствами и широко используется в различных промышленных процессах.
Взаимодействие натрия с хлором

Натрий и хлор – это два вещества, которые обладают высокой реакционной способностью. Их взаимодействие приводит к образованию хлорида натрия (NaCl), который широко известен как поваренная соль.
Взаимодействие натрия с хлором происходит при повышенных температурах. Это реакция окисления-восстановления, в ходе которой натрий отдает один электрон хлору. При этом натрий окисляется, превращаясь в положительный ион Na+, а хлор восстанавливается, образуя отрицательный ион Cl-. Образовавшиеся ионы Na+ и Cl- притягиваются друг к другу электростатическими силами и образуют кристаллическую решетку хлорида натрия.
Хлорид натрия обладает рядом химических и физических свойств, которые делают его полезным в ряде промышленных и бытовых целей. Он обладает высокой растворимостью в воде и может образовывать гигроскопическую смесь. Хлорид натрия используется в пищевой промышленности, в качестве консерванта и приправы. Он также применяется в медицине, для инъекций и внутривенного питания.
Роль натрия в организме

Натрий является одним из важнейших микроэлементов, необходимых для нормальной работы организма человека. Он выполняет множество функций и обеспечивает баланс внутриклеточной и межклеточной жидкостей.
Один из основных процессов, в которых участвует натрий, - это поддержание нормального уровня воды в организме. Натрий регулирует разведение воды в клетках и уровень жидкости в кровеносной системе, предотвращая возникновение отеков. Этот микроэлемент помогает организму впитывать и удерживать питьевую воду, содержит ее во внеклеточном пространстве и поддерживает нормальное давление крови.
Кроме того, натрий участвует в передаче нервных импульсов и сокращении мышц. Он помогает поддерживать электролитный баланс в организме, обеспечивая нервным клеткам и мышцам необходимые ионные потоки. Натрий также играет роль в поддержании кислотно-щелочного баланса и участвует в обмене веществ.
За недостатком натрия могут возникать различные проблемы со здоровьем, такие как головокружение, слабость, судороги, понижение артериального давления и нарушение функционирования нервной системы.
Однако необходимо помнить, что поглощение большого количества натрия, особенно в виде соли, может привести к гипертонии, повышенному давлению и проблемам с сердечно-сосудистой системой. Поэтому важно умеренно употреблять продукты, богатые натрием, и соблюдать рекомендованную суточную норму.
Применение натрия в промышленности

1. Производство соды. Натрий является основным сырьем для производства соды (Na2CO3), одного из важнейших химических продуктов в промышленности. Сода широко используется в стекольной, химической, металлургической и других отраслях промышленности. Она служит сырьем для производства бытовых моющих средств, стекла, бумаги, а также в качестве реагента в различных химических процессах.
2. Поддержание атмосферного давления. Натрий используется в промышленности для контроля и поддержания атмосферного давления в определенных процессах. Например, в производстве электроники и полупроводников натрий применяется для создания вакуума и предотвращения окисления материалов.
3. Производство алюминия. Натрий является важным компонентом в процессе электролиза для получения алюминия. В промышленности натрий используется как добавка к алюминиевому оксиду (Al2O3), что позволяет снизить температуру плавления и улучшить проводимость раствора.
4. Очистка металлов. Натрий применяется для очистки различных металлов от примесей. Например, в процессе очистки алюминия натрий растворяет примеси серы, что позволяет получить более чистый металл.
5. Производство сплавов. Натрий используется при производстве различных сплавов с другими металлами. Это позволяет улучшить их механические свойства и устойчивость к коррозии. Например, сплавы натрия с калием или цезием применяются в ядерной энергетике.
Вопрос-ответ

Каковы химические свойства металла натрия?
Металл натрия обладает высокой активностью, быстро окисляется на воздухе и реагирует с водой, выбрав из нее кислород и образуя гидроксид натрия. Он также способен взаимодействовать с кислородом, серой, хлором и другими элементами.
Что происходит при взаимодействии натрия с водой?
Когда металл натрия попадает в воду, он быстро реагирует с ней, выбрав из воды кислород и образуя гидроксид натрия. В этой реакции выделяется большое количество тепла и образуется водородный газ.
Почему натрий окисляется на воздухе?
Металл натрия обладает высокой активностью и реагирует с кислородом воздуха. При контакте натрия с кислородом происходит окисление, и на поверхности металла образуется оксид натрия.
Какие вещества могут реагировать с металлом натрия?
Натрий может реагировать с кислородом, серой, хлором и другими химическими элементами. Он также может взаимодействовать с веществами, содержащими гидроксиды, оксиды и кислоты.
