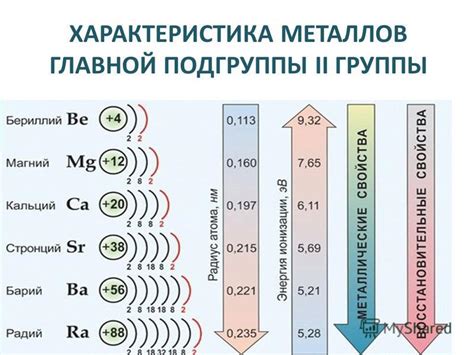
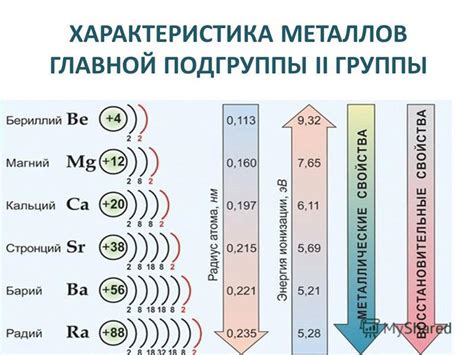
Металлы главной подгруппы 2 группы периодической системы химических элементов представляют собой важную категорию металлов с особыми свойствами. Эти металлы включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают сходными химическими свойствами и имеют своеобразную структуру кристаллической решетки, что делает их уникальными и привлекательными для изучения.
Основное химическое свойство металлов главной подгруппы 2 группы - их активность с водой и кислородом. Например, бериллий и магний проявляют способность реагировать с водой, образуя соответствующие гидроксиды и высвобождая водород. Кальций и стронций не реагируют с водой, но реагируют с кислородом воздуха, образуя соответствующие оксиды. Барий и радий проявляют максимальную активность, реагируя с водой и кислородом с высвобождением большого количества энергии.
Металлы главной подгруппы 2 группы также характеризуются своей способностью образовывать соли. Например, их соединения с хлором, сульфатами и нитратами занимают важное место в химической промышленности и медицине. Барий, например, находит применение в рентгенологии, благодаря своей способности образовывать сульфаты и хлориды, которые обладают особым рентгеноконтрастным свойством.
Химические свойства металлов главной подгруппы 2
Металлы главной подгруппы 2 характеризуются своими уникальными химическими свойствами. Эти металлы включают магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают высокой реакционной способностью и реагируют с кислородом и водой.
Одно из наиболее известных свойств этих металлов - их способность реагировать с водой. При контакте с водой они образуют гидроксиды, например, металл главной подгруппы 2 реагирует с водой и образует гидроксид металла и молекулы воды.
Еще одним важным химическим свойством металлов главной подгруппы 2 является их способность образовывать соли с кислородными кислотами. Например, кальций (Ca) может образовывать кальциевые соли с азотной кислотой (HNO3), серной кислотой (H2SO4) и другими. Эти соли широко используются в различных областях, таких как медицина, сельское хозяйство и технологическая промышленность.
Металлы главной подгруппы 2 также обладают высокой температурной стабильностью. Они имеют высокую плавкость и пластичность, что делает их полезными в различных процессах обработки металла и производстве различных изделий.
Общая химическая активность металлов главной подгруппы 2 увеличивается по мере движения вниз по группе. Например, магний (Mg) менее активен химически, чем радий (Ra). Это связано с увеличением радиуса атомов и увеличением энергии реакции.
Главная подгруппа 2 группы в презентации: основные особенности и свойства
Металлы главной подгруппы 2 группы химического элементов являются одними из самых распространенных в природе. Их отличает наличие двух электронов в внешней оболочке, что делает их хорошими проводниками электричества. Это такие элементы, как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Основные свойства металлов главной подгруппы 2 группы:
- Металлы данной группы обладают высокой температурой плавления и кипения, что связано с сильными межатомными взаимодействиями. К примеру, барий имеет температуру плавления около 727 градусов Цельсия.
- Они имеют серебристо-белый цвет и блестящую поверхность.
- Металлы главной подгруппы 2 группы обладают химической активностью, проявляющейся в реакции с кислородом, водой и кислотами. Например, реакция магния с кислородом происходит с выделением яркого пламени.
- Они образуют ионы положительного заряда при потере двух электронов, что делает их способными образовывать соли и ионы.
- Металлы главной подгруппы 2 группы способны к образованию сплавов с другими металлами, что повышает их прочность, твердость и другие механические свойства.
Изучение металлов главной подгруппы 2 группы имеет большое практическое значение. Они находят применение в различных областях, включая строительство, медицину, энергетику и многие другие. Бериллий, например, используется в производстве сплавов и электроинструментов, а магний применяется в авиастроении и автомобильной промышленности.
Реакции металлов главной подгруппы 2 с кислородом: примеры

Металлы главной подгруппы 2 группы периодической системы, такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), проявляют активность при реакции с кислородом.
Одним из примеров реакции металлов главной подгруппы 2 с кислородом является горение магния. При нагревании магния на воздухе он быстро сгорает с ярким пламенем, образуя белый порошок оксида магния (MgO). Реакция происходит по следующему уравнению: 2Mg + O2 → 2MgO.
Кальций, стронций и барий также реагируют с кислородом, образуя соответствующие оксиды. Например, кальций горит с ярким пламенем при взаимодействии с кислородом, образуя белый порошок оксида кальция (CaO). Реакция выглядит следующим образом: 2Ca + O2 → 2CaO.
Стронций и барий также образуют соответствующие оксиды при реакции с кислородом. Стронций при горении с кислородом образует оксид стронция (SrO), а барий – оксид бария (BaO).
Реакции металлов главной подгруппы 2 с кислородом являются химическими реакциями, проявляющими активность данных металлов. Образующиеся оксиды обладают химической стабильностью и используются в различных отраслях промышленности и в научных исследованиях.
Металлы главной подгруппы 2 и их взаимодействие с кислотами
Металлы главной подгруппы 2 – это элементы, которые находятся во второй главной подгруппе периодической системы. К ним относятся бериллий, магний, кальций, стронций, барий и радий. Они обладают различными химическими свойствами, но их одной из основных особенностей является их способность взаимодействовать с кислотами.
Как правило, металлы главной подгруппы 2 реагируют с кислотами, образуя соли и выделяя газы. Например, бериллий реагирует с растворами сильных кислот, таких как серная и соляная кислоты, образуя соответствующие соли и выделяя газ водород. Магний также активно взаимодействует с кислотами, образуя соли и выделяя газ водород. Кальций и другие металлы главной подгруппы 2 проявляют аналогичные свойства.
Взаимодействие металлов главной подгруппы 2 с кислотами обусловлено их способностью отдавать два электрона, образуя ионы с положительным зарядом. Это свойство позволяет им образовывать стабильные соединения с кислотами.
В заключение, металлы главной подгруппы 2 обладают способностью активно взаимодействовать с кислотами, образуя соли и выделяя газы. Это является одной из их основных химических особенностей и обусловлено их способностью отдавать два электрона при взаимодействии с кислотами.
Формирование оксидов и их использование в промышленности

Металлы главной подгруппы 2 группы в химических реакциях образуют различные оксиды. Оксиды представляют собой соединения металлов с кислородом. В зависимости от степени окисления металла, оксиды могут быть двух типов - основными и амфотерными. Основные оксиды образуются при низких степенях окисления металла, амфотерные - при более высоких степенях окисления.
Полученные оксиды находят широкое применение в промышленности. Основные оксиды используются в процессе синтеза различных органических соединений, производства электролитических растворов и катализаторов. Некоторые из них имеют антисептические свойства и применяются в медицине для лечения инфекционных заболеваний.
Амфотерные оксиды находят применение в производстве электролитических аккумуляторов, стекла, керамики. Они служат основой для производства цемента и силикатных материалов. Помимо этого, амфотерные оксиды активно применяются в процессе очистки воды и сточных вод.
Вопрос-ответ

Какие металлы входят в главную подгруппу 2 группы?
В главную подгруппу 2 группы входят металлы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какие особенности химических свойств металлов главной подгруппы 2 группы?
Металлы главной подгруппы 2 группы обладают рядом общих химических свойств. Например, они образуют ион металла c двумя положительными зарядами (например, Mg2+, Ca2+). Кроме того, они образуют амфотерные оксиды, то есть оксиды, которые реагируют как с кислотами, так и с щелочами. Взаимодействуя с кислотами, они образуют соли, а взаимодействуя с щелочами, образуют гидроксиды. Эти металлы также обладают высокой химической активностью и горением в кислороде при высоких температурах.
