Металлы - это элементы, обладающие характерными физическими и химическими свойствами. Они образуют основу всего материального мира и играют важную роль в нашей жизни. Химические формулы металлов позволяют описать их состав и структуру, а также предсказать их реакционную способность и свойства.
Металлы можно классифицировать по различным признакам, в том числе и по их химическим формулам. Некоторые металлы образуют соединения с одним атомом, например, натрий (Na), калий (K) и железо (Fe). Они имеют простую структуру и химическую формулу, состоящую из одного символа. Другие металлы могут образовывать соединения с несколькими атомами, такие как медь (Cu), серебро (Ag) и золото (Au). Их химические формулы содержат несколько символов и указывают на количество атомов каждого элемента.
Важной характеристикой металлов является их атомная масса, которая указывает на массу одного атома элемента. Часто металлы образуют ионы путем отдачи электронов, что влияет на структуру и химические свойства соединений. Химические формулы металлов могут также указывать на заряд ионов при их образовании, что помогает определить степень окисления металла. Это важная информация при расчете реакционных способностей и возможных реакций металлов.
Группа щелочных металлов

Щелочные металлы - это элементы, образующие первую группу периодической системы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы отличаются рядом химических и физических свойств. Во-первых, они очень реактивны и легко реагируют с водой и кислородом. Это свойство делает их полезными в различных промышленных и химических процессах.
Щелочные металлы обладают высокой электроотрицательностью и образуют ионные соединения с другими элементами. Они имеют низкую плотность и низкую точку плавления, что делает их легкими металлами.
Кроме того, щелочные металлы обладают высокой проводимостью тепла и электроэнергии. Это свойство делает их полезными в электротехнике и производстве электроники.
Наиболее распространенным щелочным металлом в повседневной жизни является натрий. Натрий используется в пищевой промышленности для соления и консервирования продуктов, а также в производстве стекла и мыла. Калий широко применяется в сельском хозяйстве как удобрение, а также в производстве удобрений и взрывчатых веществ.
Легкоземельные металлы
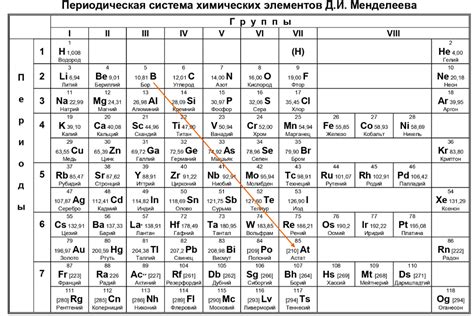
Легкоземельные металлы - это группа металлов, которые находятся в периодической таблице между группами 2 и 13. Они также известны как группы лантаноидов и актиноидов. Всего в этой группе насчитывается 15 элементов.
Легкоземельные металлы обладают рядом общих свойств. Они являются мягкими, благородными металлами с низкой плотностью и плохой электропроводностью. Они также обладают высокой реактивностью и способностью образовывать стабильные ионные соединения.
Наиболее известными легкоземельными металлами являются лантан, церий, прометий, неодим и уран. Эти элементы широко используются в различных отраслях промышленности, включая производство электроники, катализаторов, магнитов и ядерной энергетики.
Легкоземельные металлы также обладают интересными свойствами, которые делают их полезными в различных научных исследованиях. Например, они используются в качестве стабилизаторов в оптических материалах и в процессе синтеза новых соединений.
Тяжелоземельные металлы
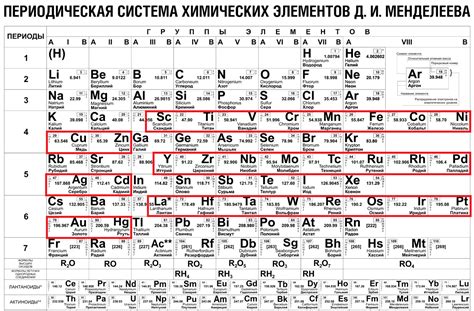
Тяжелоземельные металлы – это группа металлов, которые составляют особую часть периодической системы химических элементов. Они представляют собой группу 17 элементов, расположенных в периоде с пятью 3d-элементами и десятью 4f-элементами. К ним относятся: иттрий (Y), лантан (La), лантаноиды (Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb и Lu), а также скандий (Sc).
Тяжелоземельные металлы обладают рядом особенностей, которые делают их полезными в различных областях. Их главным применением является производство специальных магнитов, которые находят применение в энергетике, электронике, медицине и других отраслях. Кроме того, эти металлы используются в производстве светоизлучающих приборов, каталитических систем, фармацевтических препаратов и очистке сточных вод.
Тяжелоземельные металлы обладают специфическими химическими свойствами, которые отличают их от других элементов. Они обладают высокой плотностью и температурой плавления, а также являются химически устойчивыми. Благодаря своим свойствам, они играют важную роль в современной технологии и научных исследованиях.
Переходные металлы

Переходные металлы - это группа элементов, которые находятся в периодической таблице между щелочными и щелочноземельными металлами. Всего в этой группе насчитывается 38 элементов, включая титан, железо, медь и цинк.
Характерной особенностью переходных металлов является наличие переменных степеней окисления. Это означает, что они способны образовывать несколько ионов различной зарядности. Например, железо может образовывать ионы Fe2+ и Fe3+, а медь - ионы Cu+ и Cu2+.
Переходные металлы обладают хорошей проводимостью электричества и тепла. Они также обладают высокой плотностью и твердостью. Это делает их идеальными материалами для изготовления проводов, кабелей, металлоконструкций и других прочных материалов.
Некоторые переходные металлы имеют широкое применение в химической индустрии. Например, железо используется для производства стали, которая является основным строительным материалом. Медь используется для производства проводов и электрических кабелей.
Переходные металлы также имеют важное значение для живых организмов. Они являются неотъемлемой частью многих ферментов и белков, необходимых для нормального функционирования организма.
Металлы блоков s и p

Металлы блоков s и p это элементы периодической системы, которые расположены слева и справа от линии деления между металлами и неметаллами.
Металлы блока s включают элементы первых двух групп периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают высокой электропроводностью, хорошей термической и электрической проводимостью, а также хорошей деформируемостью и пластичностью.
Металлы блока p включают элементы последних шести групп периодической системы: бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и элементы всех шести периодов (P, S, Cl, Se, Br, I). Эти элементы также обладают металлическими свойствами, но их характеристики могут немного отличаться от металлов блока s. Например, алюминий является хорошим проводником электричества, но его проводимость ниже, чем у металлов блока s.
Металлы блоков s и p широко используются в различных отраслях промышленности, электротехнике, строительстве и других областях. Они часто входят в состав сплавов, используются для создания проводников, конструкционных материалов, катализаторов и других продуктов.
Лантаниды и актиноиды

Лантаниды и актиноиды являются двумя сериями элементов, которые находятся внутри лантанового и актиноидного ряда соответственно в периодической системе. Они представляют собой группу металлов, характеризующихся особыми свойствами и структурой атома.
Лантаниды состоят из 15 элементов, начиная с лантана (La) и заканчивая лютецием (Lu). Они имеют похожую химическую активность и обладают схожими физическими свойствами. Одно из основных свойств лантанидов – способность к образованию стабильных соединений с органическими и неорганическими веществами.
Актиноиды включают 15 элементов, начиная с актиния (Ac) и заканчивая лоренцием (Lr). Они также обладают схожими химическими и физическими свойствами, однако имеют большую электронную конфигурацию, что делает их более энергетически активными. Особенностью актиноидов является их радиоактивность и возможность образования соединений с очень высокими координационными числами.
Оба ряда элементов – лантаниды и актиноиды – обладают большим значением энергии электронного уровня f и характерным расположением этих электронов внутри атома. Лантаниды и актиноиды имеют важное применение в различных областях науки и техники, включая каталитические процессы, фотонику, электрохимические устройства и др.
Посттрансиционные металлы
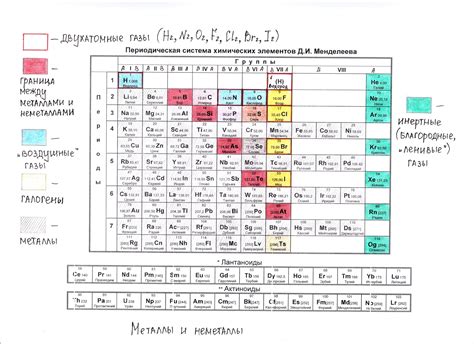
Посттрансиционные металлы - это группа металлов, которые расположены в периодической системе элементов между двумя основными группами металлов - щелочными и щелочноземельными металлами. Они также называются побочными или "блоком d" металлами.
Главной особенностью посттрансиционных металлов является их электронная конфигурация, которая включает полностью заполненные подуровни d-субоболочки и неполностью заполненные п- или f-субоболочки. У этих металлов также выражена тенденция к образованию разнообразных оксидов, сульфидов и других соединений с различной степенью окисления.
К посттрансиционным металлам относятся такие элементы, как цинк (Zn), кадмий (Cd), галлий (Ga), индий (In), олово (Sn), свинец (Pb), таллий (Tl) и громкозвучный тормоз (Cn). Их химические свойства и реактивность могут значительно варьировать, что делает их полезными в различных промышленных и научных приложениях.
- Цинк (Zn) - широко используется в гальванике, производстве сплавов и в качестве катализатора.
- Кадмий (Cd) - используется в аккумуляторах, пигментах и пластике.
- Галлий (Ga) - применяется в полупроводниковой и оптической технологии.
- Олово (Sn) - используется в производстве жестяных консервных банок и других металлических изделий.
- Свинец (Pb) - широко использовался в прошлом в производстве аккумуляторов, но его использование было сокращено из-за его токсичности.
- Таллий (Tl) - применяется в электронике и оптике.
- Громкозвучный тормоз (Cn) - это супертяжелый химический элемент, который был открыт искусственно и имеет очень короткое время жизни.
Посттрансиционные металлы играют важную роль в различных областях, включая технологию, металлургию и научные исследования. Их химические свойства и способность образовывать соединения с различными степенями окисления делают их ценными элементами для различных промышленных и научных приложений.
Вопрос-ответ

Какие существуют классификации химических формул металлов?
Существуют различные способы классификации химических формул металлов. Одной из самых распространенных является классификация по степени окисления металлов. В этом случае металлы делятся на две группы: металлы I-IV степени окисления и металлы V-VIII степени окисления. Также можно классифицировать металлы по их свойствам, например, по температуре плавления или электропроводности.
Что означает степень окисления металлов?
Степень окисления металла - это числовое значение, указывающее на количество электронов, которые металл может принять или отдать во время химической реакции. В химической формуле металла степень окисления указывается римскими цифрами после его символа. Например, степень окисления железа в соединении Fe2O3 равна III.
Какие металлы относятся к металлам I-IV степени окисления?
К металлам I-IV степени окисления относятся такие металлы, как натрий (Na), калий (K), железо (Fe), медь (Cu) и другие. Эти металлы способны отдавать от одного до четырех электронов во время химических реакций.
Какие металлы относятся к металлам V-VIII степени окисления?
К металлам V-VIII степени окисления относятся, например, марганец (Mn), хром (Cr), никель (Ni), серебро (Ag) и другие. Эти металлы способны принимать от одного до восьми электронов во время химических реакций.
