Металлы – это особый класс элементов, имеющих специфическую структуру и свойства. Основу металлической структуры составляют атомы, которые обладают определенными особенностями. Атомы металлов являются одними из основных строительных блоков всего материального мира.
Главной характеристикой атомов металлов является наличие свободных электронов в их внешних энергетических оболочках. Это явление отличает металлы от других типов элементов, таких как неметаллы или полуметаллы. Свободные электроны позволяют атомам металлов образовывать межатомные связи, что приводит к образованию кристаллической решетки.
В металлической решетке атомы металлов располагаются регулярно и симметрично, образуя кристаллическую структуру. Это обеспечивает металлам их основные свойства - прочность, твердость и проводимость электричества и тепла. Кристаллическая решетка также определяет поведение металлов при различных воздействиях, таких как деформация, нагревание или охлаждение.
Атомы металлов обладают высокой подвижностью благодаря наличию свободных электронов, которые могут передвигаться по всей кристаллической решетке. Это особенное свойство позволяет металлам иметь высокую пластичность и способность принимать различные формы без разрушения.
Изучение строения атомов металлов является важным для понимания их свойств и применения в различных отраслях науки и техники. Благодаря своей уникальной структуре, металлы нашли широкое применение в производстве конструкционных материалов, электроники, авиации, химической промышленности и других сферах.
Понятие исследуемого объекта

Строение атомов металлов является предметом изучения в области физики и химии. Атом - это наименьшая частица химического элемента, состоящая из ядра и электронной оболочки. Процесс изучения строения атомов и их особенностей позволяет получить более глубокое понимание свойств металлов и разработать новые материалы и технологии.
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны являются нейтральными по заряду. Количество протонов в ядре определяет атомный номер элемента и его расположение в периодической системе химических элементов.
Около ядра находятся электроны, которые образуют электронную оболочку. Электроны имеют отрицательный заряд и двигаются по орбитам вокруг ядра. Количество электронов в атоме равно количеству протонов, что обеспечивает электрическую нейтральность атома.
Строение атомов металлов обладает определенными особенностями. В металлах электронная оболочка состоит из нескольких орбит, называемых энергетическими уровнями. Некоторые энергетические уровни металлов могут быть частично заполнены электронами, что делает металлы проводниками электричества. Благодаря этому свойству металлы находят широкое применение в различных областях, включая электронику и электротехнику.
Строение атома металла: элементарная частица и орбитальная модель
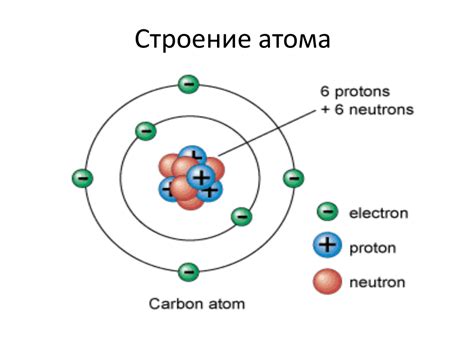
Атом металла является основной структурной единицей металлического материала. Он состоит из элементарных частиц – протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, в то время как электроны движутся по орбитальным оболочкам вокруг ядра.
Протоны и нейтроны обладают положительным зарядом и имеют массу близкую к единице атомной массы. Они находятся в ядре атома, которое состоит из протонов и нейтронов. Протоны определяют заряд ядра и характеристики элемента, а нейтроны несут на себе нейтральный заряд и обеспечивают стабильность ядра.
Электроны, в свою очередь, обладают отрицательным зарядом и имеют массу много меньшую, чем протоны и нейтроны. Они движутся по орбитальным оболочкам, которые представляют собой энергетические уровни вокруг ядра. У каждой оболочки есть свои энергетические уровни, на которых может находиться определенное количество электронов.
Строение атома металла определяет его химические и физические свойства, такие как коррозионная стойкость, пластичность, электропроводность и другие. Элементарная частица и орбитальная модель помогают понять основные свойства металлических материалов и используются в научных исследованиях и технических применениях.
Внешняя электронная оболочка металлического атома
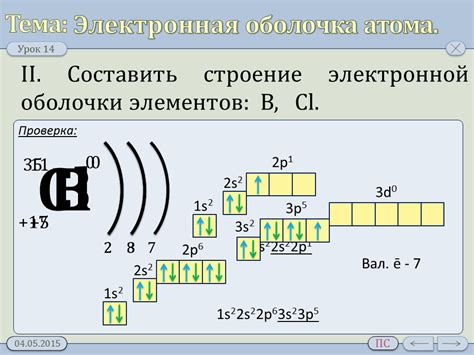
Внешняя электронная оболочка металлического атома является ключевым элементом, определяющим химические и физические свойства металлов. Она состоит из валентных электронов, которые находятся на наиболее удаленных энергетических уровнях от ядра атома.
Валентные электроны обладают свободной подвижностью, что является одной из причин, почему металлы обладают высокой электропроводностью и теплопроводностью. Именно благодаря свободным электронам металлы способны эффективно передавать электрический ток и тепло.
Количество валентных электронов у металлов определяет их химическую активность. Поэтому металлы с небольшим количеством валентных электронов чаще образуют ионы с положительным зарядом и являются химически активными элементами.
Большинство металлов имеют несколько валентных электронов, что позволяет им формировать различные соединения с другими элементами, как положительными, так и отрицательными зарядами. В то же время, металлы могут образовывать сплавы с другими металлами, что расширяет их применение в различных областях промышленности и технологий.
Ядро атома металла: протоны, нейтроны, атомный номер и массовое число
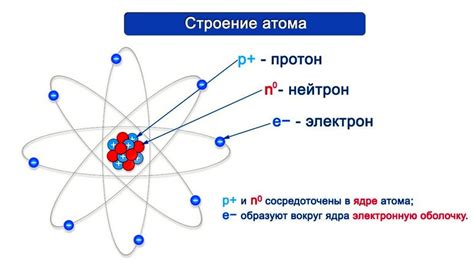
Ядро атома металла является его центральной частью и содержит протоны и нейтроны. Протоны - это положительно заряженные элементарные частицы, имеющие массу приблизительно равную единице. Нейтроны, в свою очередь, не имеют заряда и также имеют примерно равную массу. Основная функция ядра атома металла - обеспечение его стабильности и определение его химических свойств.
Атомный номер металла указывает на количество протонов в его ядре. Каждый металл имеет свой уникальный атомный номер, который служит для его идентификации и классификации в периодической таблице элементов. Число протонов также определяет число электронов в атоме, так как атом обычно является электрически нейтральным и содержит одинаковое количество положительных и отрицательных зарядов.
Массовое число атома металла равно сумме числа протонов и нейтронов в его ядре. Оно указывает на приблизительную массу атома и может быть различным для атомов одного и того же элемента, если они имеют разное число нейтронов. Изотопы - это атомы одного и того же элемента с разным числом нейтронов и, следовательно, разным массовым числом.
Характеристики атомного ядра металла: плотность, радиус, заряд
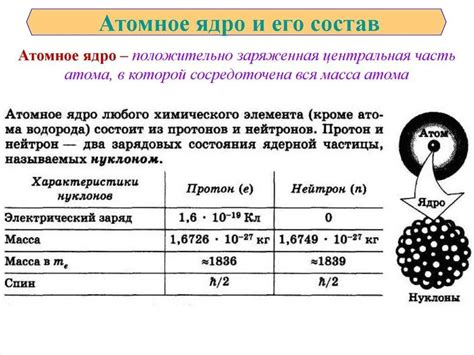
Плотность атомного ядра металла является одной из его основных характеристик. Она определяет массу ядра в единице объема. Плотность атомного ядра металла зависит от числа протонов и нейтронов в ядре, а также от распределения этих частиц внутри ядра. Чем больше протонов и нейтронов в ядре, тем выше плотность ядра металла.
Радиус атомного ядра металла определяет размеры самой компактной области атома. Радиус ядра металла пропорционален числу протонов и нейтронов в ядре. Чем больше число протонов и нейтронов, тем больше радиус ядра металла. Радиус атомного ядра металла можно выразить в ангстремах или в метрах.
Заряд атомного ядра металла определяет его электростатическое взаимодействие с электронами. Заряд атомного ядра металла равен сумме положительных зарядов протонов в ядре. Заряд ядра металла обычно приводится в единицах элементарного заряда. Чем больше протонов в ядре, тем выше заряд атомного ядра металла.
Взаимодействие металлических атомов: кристаллическая решетка и связи
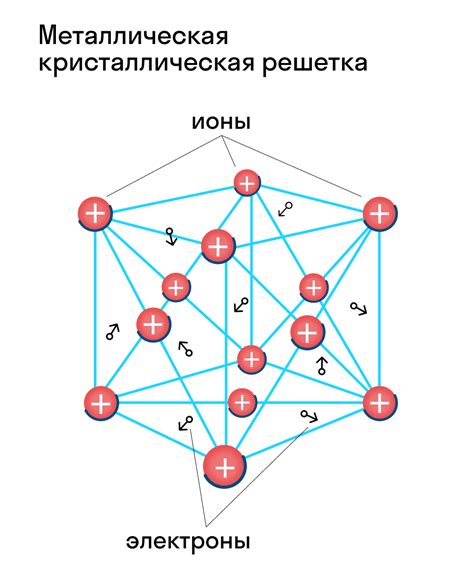
Металлические атомы образуют кристаллическую решетку, что делает металлы одним из основных классов материалов, широко используемых в промышленности. Кристаллическая решетка представляет собой трехмерную структуру, состоящую из регулярно расположенных атомов. Этот тип структуры обеспечивает металлам их уникальные свойства, такие как высокая прочность и электропроводность.
Связь между атомами в металлической решетке осуществляется посредством так называемых металлических связей. Они характеризуются тем, что внешние электроны атомов металла не принадлежат отдельным атомам, а перемещаются по всей решетке. Это обеспечивает свободное движение электронов и способность металла проводить электрический ток.
Металлические связи также отвечают за высокую прочность металлов. При воздействии на металлическую решетку внешней нагрузкой или напряжением, электроны могут перемещаться и сглаживать дефекты в структуре. Это позволяет металлам обладать хорошими механическими свойствами, такими как устойчивость к деформации и пластичность.
В целом, взаимодействие металлических атомов определяет уникальные свойства металлов и их способность использоваться в различных отраслях промышленности, включая машиностроение, электротехнику, строительство и другие. Понимание кристаллической структуры металлов и принципов их взаимодействия позволяет создавать новые материалы с улучшенными свойствами и расширять область их применения.
Особенности строения атомов различных металлов: переходные, благородные, щелочные и др.

Атомы металлов имеют свои характеристики и особенности в зависимости от их положения в периодической системе. Переходные металлы, такие как железо, медь и никель, обладают сложным строением атома. Их электронные оболочки содержат как заполненные, так и незаполненные d-орбитали, что позволяет им образовывать различные связи и обладать разнообразными физическими свойствами.
Благородные металлы, такие как золото, платина и серебро, имеют полностью заполненные s- и d-орбитали. Благодаря этому, они обладают высокой устойчивостью, химически инертны и имеют блеск.
Щелочные металлы, такие как натрий, калий и литий, имеют один электрон на своей внешней электронной оболочке. Это делает их очень реакционноспособными, так как они стремятся отдать этот электрон и образовать положительный ион. Они легко взаимодействуют с водой и выделяются природными огнеметами.
Атомы других металлов, таких как алюминий, магний и цинк, имеют различное число электронов на своих электронных оболочках, что определяет их химическую активность и свойства.
Таким образом, строение атомов различных металлов определяет их химические и физические свойства, что делает их особенными и востребованными в различных отраслях промышленности.
Вопрос-ответ

Какие основные характеристики строения атомов металлов?
Атомы металлов имеют относительно большую размерность, свободные электроны и являются положительно заряженными ионами.
В чем заключается особенность строения атомов металлов?
Особенностью строения атомов металлов является наличие ядра, окруженного облаком электронов. Данный тип строения обуславливает большую проводимость тепла и электричества у металлов.
Как свободные электроны определяют свойства металлов?
Свободные электроны в атомах металлов позволяют проводить электричество и тепло. Они также ответственны за способность металлов к деформации и образованию кристаллической решетки.
