Щелочные металлы - это элементы периодической системы, относящиеся к 1-й группе. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют низкую плотность, мягкие и пластичные. Они обладают хорошей проводимостью электричества и тепла. Щелочные металлы обычно образуют однозарядные положительные ионы, поэтому они легко реагируют с другими веществами, особенно с водой.
Щелочные металлы обладают характерными свойствами, такими как низкая электроотрицательность, малая ионизационная энергия и большая металлическая активность. Они быстро окисляются на воздухе, образуя оксидные пленки на поверхности, которые затем могут реагировать с водой или другими реагентами.
Основные свойства щелочных металлов:
- Низкая плотность: щелочные металлы имеют низкую плотность, что делает их легкими и плавающими на поверхности воды.
- Металлическая активность: щелочные металлы обладают высокой металлической активностью, что делает их хорошими веществами для создания реакций и образования соединений.
- Низкая электроотрицательность: щелочные металлы имеют низкую электроотрицательность, что означает, что они имеют тенденцию отдавать электроны.
- Высокая ионизационная энергия: щелочные металлы имеют низкую ионизационную энергию, что делает их легко ионизирующимися.
- Реакция с водой: щелочные металлы быстро реагируют с водой, образуя щелочные растворы и выделяя водород.
Определение щелочных металлов и их классификация
Щелочные металлы — группа элементов, включающая в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они располагаются в первой группе периодической системы элементов и характеризуются уникальными свойствами.
Химические элементы этой группы обладают низкой плотностью и низкой температурой плавления. Они являются отличными проводниками электричества и тепла, а также обладают положительными окислительными свойствами.
Щелочные металлы можно классифицировать по различным признакам. Один из таких признаков — атомная масса. Литий имеет наименьшую атомную массу, равную примерно 6,94 атомных единиц, а франций имеет наибольшую атомную массу, примерно 223, к 97.
Другой признак классификации — плотность. Калий имеет наибольшую плотность среди щелочных металлов, равную примерно 0,86 г/см³, в то время как литий имеет наименьшую плотность, примерно 0,53 г/см³.
Также щелочные металлы можно классифицировать по интервалу температуры плавления. Натрий, калий, рубидий и цезий обычно плавятся при комнатной температуре и являются жидкими. Литий имеет самую низкую температуру плавления среди щелочных металлов, примерно 180 градусов по Цельсию.
Физические характеристики щелочных металлов

Щелочные металлы представляют собой группу элементов, включающих литий, натрий, калий, рубидий, цезий и франций. Все эти металлы характеризуются рядом уникальных физических свойств, которые делают их отличными от других элементов периодической таблицы.
Одной из заметных особенностей щелочных металлов является их низкое плотное состояние. Например, литий имеет плотность всего 0,53 г/см³ при комнатной температуре и давлении. Такая низкая плотность делает щелочные металлы очень легкими и легко применимыми в различных областях науки и техники.
Важной физической характеристикой щелочных металлов является их низкая температура плавления. Например, натрий плавится при температуре всего 97,8 °C, что делает его очень легко переводимым в жидкое состояние. Это свойство щелочных металлов используется в различных промышленных процессах, включая производство стекла и лужения металлов.
Щелочные металлы также отличаются высокой электропроводностью и теплопроводностью. Это связано с наличием свободных электронов, которые могут свободно передвигаться по кристаллической решетке. Благодаря этим свойствам, щелочные металлы широко используются в электротехнике и металлургии.
В целом, физические характеристики щелочных металлов делают их уникальными и полезными в различных сферах жизни. Изучение и использование этих металлов имеет большое значение для науки и техники и продолжает привлекать внимание ученых и инженеров.
Химические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы, включающей литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом химических свойств, которые делают их уникальными и широко используемыми в различных областях науки и промышленности.
Одним из основных химических свойств щелочных металлов является их способность активно взаимодействовать с кислородом и образовывать оксиды. Это объясняет, почему щелочные металлы легко окисляются в присутствии воздуха. Также они реагируют с водой, образуя гидроксиды, которые являются щелочами. Например, реакция калия с водой протекает с образованием гидроксида калия и выделением водорода.
Другим важным свойством щелочных металлов является их активность в реакциях с неорганическими и органическими кислотами. Они образуют соли, которые имеют множество практических применений. Например, смеси натрия и калия используются для производства щелочных батарей. Также калий используется в производстве удобрений и стекла, а рубидий – в производстве лазеров.
Щелочные металлы также обладают высокой электропроводностью и способностью образовывать одноатомные ионные катионы. Они легко реагируют с другими элементами и соединениями, что позволяет использовать их в различных химических реакциях и синтезе органических соединений.
Выводя их из электрохимических реакций, можно заметить, что щелочные металлы обладают высокой активностью, что делает их опасными для хранения и использования. Они должны быть хранены в защищенных от воздействия влаги и кислорода контейнерах, чтобы предотвратить их окисление и взаимодействие с окружающей средой.
Применение щелочных металлов в науке и промышленности
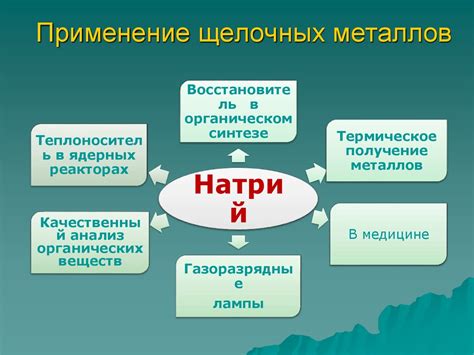
Щелочные металлы – это элементы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они обладают низкой плотностью, мягкостью и реактивностью кислорода и воды.
Одно из главных применений щелочных металлов в науке – это использование их в качестве катализаторов. Например, рубидий и калий являются важными каталитическими компонентами в химической промышленности, применяемыми при синтезе органических соединений.
В промышленности щелочные металлы находят широкое применение в производстве лугов, стекла, щелочей, щелочных аккумуляторов, а также в процессах производства стали, алюминия и других металлов.
Кроме того, натрий и калий нашли свое применение в пищевой промышленности, где они используются для регулирования вкуса, консервации и очистки пищевых продуктов. Рубидий и цезий используются в различных электронных устройствах, таких как фотоэлементы и детекторы радиации.
Важно отметить, что щелочные металлы также применяются в медицине. Литий, например, используется в лекарственных препаратах для лечения биполярного расстройства и депрессии.
Вопрос-ответ

Какова химическая структура щелочных металлов?
Щелочные металлы имеют простую химическую структуру - каждый атом щелочного металла имеет одну валентную электронку во внешней электронной оболочке. Это делает их очень реакционноспособными и склонными к образованию ионов с положительным зарядом.
В чем причина того, что щелочные металлы реагируют с водой? Что происходит при такой реакции?
Процесс реакции щелочных металлов с водой основан на том, что щелочные металлы имеют очень низкую ионизационную энергию, то есть легко отдают свой электрон и превращаются в ионы с положительным зарядом. При реакции с водой, щелочный металл отдает электрон воде, образуется гидроксид щелочного металла и выделяется водородный газ.
Какая роль щелочных металлов в природе и в повседневной жизни?
Щелочные металлы широко используются в различных областях. Например, Литий используется в производстве аккумуляторов, натрий и калий используются для пищевой промышленности, рубидий и цезий применяются в исследовательских и научных работах. Кроме того, некоторые щелочные металлы используются в медицине и электронике.
