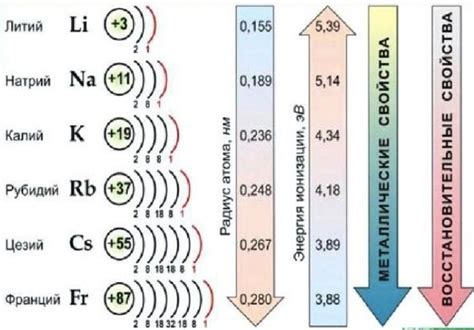
Щелочные металлы - это элементы периодической системы, относящиеся к I группе. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название из-за свойств образования щелочных оксидов и гидроксидов в реакциях с водой.
Представители этой группы характеризуются наибольшей активностью среди всех элементов. Они обладают низкой температурой плавления и кипения, а также мягкостью, что в сочетании с их реактивностью делает их очень опасными. Основные свойства щелочных металлов включают способность образовывать ионы положительного заряда (катионы), образование щелочных оксидов и гидроксидов, реакцию с водой, образование амфотерных соединений и способность окрашивать пламя.
Теперь ты готов попробовать свои знания в тесте!
Определение и общая характеристика щелочных металлов

Щелочные металлы - это элементы, являющиеся частью первой группы периодической таблицы, которая состоит из элементов с одним электроном во внешней оболочке. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Одной из основных характеристик щелочных металлов является их высокая активность. Это связано с тем, что их внешняя оболочка содержит всего один электрон, который легко отдается другим элементам при химических реакциях. Именно благодаря этой активности щелочные металлы встречаются в природе в соединенном виде, например, в виде соединений с кислородом или серой.
Они являются химически мягкими металлами с низкой плотностью, что означает, что они легкие и мягкие, и могут быть резаны ножом. Они также обладают низкими температурами плавления и кипения. Например, литий имеет наименьшую плотность и наименьшую температуру плавления среди всех металлов, а калий и рубидий можно легко расплавить в простом стеклянном корпусе.
Щелочные металлы являются хорошими проводниками тепла и электричества. Они также реагируют с водой, образуя щелочные растворы и выделяя водород. Образующиеся щелочные растворы имеют щелочную реакцию и широко используются в различных отраслях промышленности.
Физические свойства щелочных металлов

Щелочные металлы представляют собой элементы, которые относятся к первой группе периодической системы. Основные щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Во-первых, щелочные металлы являются химически активными и реактивными элементами. Они легко окисляются и образуют соединения с кислородом, хлором и другими элементами. Кроме того, они обладают высокой электроотрицательностью и способностью образовывать ионы с положительным зарядом.
Во-вторых, щелочные металлы обладают низкой плотностью и низким плавлением и кипением. Их плотность составляет примерно 0,5-1,8 г/см³, а температура плавления и кипения находятся в диапазоне от 180 до 113s ∘C и от 626 до 960 ∘C соответственно.
В-третьих, щелочные металлы хорошо проводят электричество и тепло. Они обладают высокой электропроводностью и теплопроводностью, что делает их полезными материалами в промышленности и электронике. Их электропроводность является результатом наличия свободных электронов в их структуре.
Наконец, щелочные металлы образуют светлые, блестящие поверхности, что делает их удобными для использования в ювелирных изделиях и других производствах, где требуется высокая степень отделки.
Химические свойства щелочных металлов

Щелочные металлы - группа химических элементов I группы периодической системы. Их химические свойства во многом определяются особенностями электронной структуры. Все щелочные металлы имеют один валентный электрон, что делает их очень активными.
Первое химическое свойство щелочных металлов - они легко реагируют с кислородом воздуха. Такую реакцию можно заметить на металлической поверхности, которая покрывается оксидной пленкой. В результате реакции образуется оксид металла.
Одно из наиболее известных свойств щелочных металлов - способность реагировать с водой. При контакте с водой они образуют гидроксиды щелочных металлов и выделяются водородный газ. Эта реакция является очень энергичной, что делает щелочные металлы опасными для обработки водой.
Щелочные металлы проявляют свою активность и при реакции с неметаллическими элементами. Например, они реагируют с галогенами, образуя соли галогенидов щелочных металлов. Эти соли могут иметь различные применения в синтезе органических соединений и в других областях химии.
Одно из химических свойств щелочных металлов, которое является наиболее характерным для данной группы, это их способность образовывать ионы щелочных металлов. Благодаря своей активности, щелочные металлы легко отделяются от других металлов и могут быть использованы в различных областях промышленности и науке.
Практическое применение щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое практическое применение в различных областях нашей жизни. Эти металлы обладают рядом уникальных свойств, которые делают их востребованными в различных промышленных и научных областях.
Одно из практических применений щелочных металлов - это в производстве щелочных аккумуляторов. Литий-ионные аккумуляторы, содержащие литий, обладают высокой энергетической плотностью и длительным сроком службы, что делает их идеальными для использования в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки. Натрий-ионные аккумуляторы, содержащие натрий, являются более доступной и экологически чистой альтернативой литий-ионным аккумуляторам.
Другое важное применение щелочных металлов - это в производстве стекла и керамики. Натрий и калий являются основными компонентами для производства различных видов стекла, используемого в окнах, посуде, фарфоре и т.д. Калий также используется в производстве удобрений для сельского хозяйства.
Рубидий и цезий нашли применение в различных научных и технических областях. Например, рубидий используется в атомных часах и в некоторых видеосистемах. Цезий используется в промышленности нефти и газа, а также в научно-исследовательских лабораториях для проведения точных измерений времени и в качестве источника энергии в космических аппаратах.
В целом, щелочные металлы играют важную роль в различных областях нашей жизни, от электроники и промышленности до науки и технологий. Их уникальные свойства и широкий спектр применения делают их ценным ресурсом для современного общества.
Влияние щелочных металлов на живые организмы
Щелочные металлы являются химическими элементами из первой группы периодической системы. Они включают в себя литий, натрий, калий, рубидий, цезий и франций. Эти элементы широко распространены в природе и имеют разнообразное воздействие на организмы живых существ.
Среди щелочных металлов, калий является одним из основных макроэлементов, необходимых для нормального функционирования организма человека. Он играет важную роль в регуляции водно-электролитного баланса, обмене веществ, функции сердечно-сосудистой и нервной систем.
Натрий также является важным элементом для живых организмов. Он присутствует во многих биологических системах и необходим для поддержания правильного уровня осмотического давления, регулирования кислотно-щелочного баланса и функции мембранных белков. Однако, чрезмерное потребление натрия может привести к повышенному артериальному давлению и развитию сердечно-сосудистых заболеваний.
Еще один щелочной металл - литий, имеет особое значение для нервной системы. Он используется в лечении некоторых психических расстройств, таких как биполярное аффективное расстройство и депрессия. Литий помогает стабилизировать настроение и уменьшить риск суицидальных мыслей.
Однако, несмотря на полезность щелочных металлов для живых организмов, их избыточное или недостаточное потребление может вызвать различные проблемы со здоровьем. Поэтому важно следить за балансом данных элементов в организме и употреблять их в необходимом количестве.
Тест на знание щелочных металлов
Щелочные металлы – это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к основным элементам, так как образуют щелочные оксиды и гидроксиды, растворы которых обладают щелочной средой. Теперь давай проверим свои знания о щелочных металлах.
- Какой щелочный металл широко используется в батарейках и аккумуляторах?
- Литий
- Рубидий
- Франций
- Какой щелочный металл используется в пищевой промышленности для приправы и консервации?
- Калий
- Натрий
- Цезий
- Какой щелочный металл используется для производства органических соединений и нахождения практического применения в анализе минеральных и органических веществ?
- Франций
- Рубидий
- Калий
- Какой щелочный металл имеет наибольшую атомную массу?
- Цезий
- Литий
- Франций
- Какой щелочный металл имеет самую низкую плотность в своей группе?
- Натрий
- Калий
- Литий
Ответы: 1 - Литий, 2 - Натрий, 3 - Калий, 4 - Цезий, 5 - Литий.
Вопрос-ответ

Каковы основные характеристики щелочных металлов?
Щелочные металлы это группа элементов, которые находятся в первой группе периодической таблицы элементов. Они включают литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают низкой плотностью, мягкостью, низкой температурой плавления и кипения. Они химически реактивны и легко образуют ионы с положительным зарядом. Они также хорошо проводят электричество и тепло.
Какие свойства делают щелочные металлы химически реактивными?
Щелочные металлы имеют один электрон во внешней оболочке, что делает их очень нестабильными. Они стремятся отдать этот электрон, чтобы достичь стабильной октетной конфигурации, и поэтому образуют ионы с положительным зарядом. Это делает их химически реактивными и способными проявлять активность при контакте с другими элементами или соединениями.
Какую роль играют щелочные металлы в нашей жизни?
Щелочные металлы имеют широкое применение в различных областях нашей жизни. Например, натрий используется в производстве стекла и мыла, калий является важным элементом для растительного роста и используется в удобрениях, литий используется в производстве аккумуляторов и лекарств. Они также могут быть использованы в ядерной энергетике и различных технологиях.
Какие опасности связаны с использованием щелочных металлов?
Щелочные металлы могут быть опасными при неправильном обращении с ними. Например, они реагируют с водой, образуя взрывоопасные газы, такие как водород. Они также могут вызывать ожоги на коже или повреждение глаз при контакте с ними. Поэтому, при работе с щелочными металлами необходимо соблюдать соответствующие меры предосторожности и работать в хорошо проветриваемых помещениях.
