Металлы - это группа химических элементов, которые обладают определенной структурой атома и обладают характерными химическими и физическими свойствами. Они отличаются от других элементов своими высокими степенями проводимости тепла и электричества, а также способностью образовывать блестящие поверхности.
Структура атома металла обычно состоит из положительно заряженного ядра и свободно движущихся электронов. Ядро атома содержит протоны, имеющие положительный заряд, и нейтроны, не имеющие заряда. Электроны, расположенные в энергетических оболочках вокруг ядра, имеют отрицательный заряд и обеспечивают проводимость металлов.
Химические свойства металлов определяются их способностью образовывать ионные соединения и подвергаться окислительно-восстановительным реакциям. Металлы легко отдают электроны, образуя положительно заряженные ионы, и могут соединяться с другими элементами. Это позволяет им образовывать различные соединения, такие как соли и металлические сплавы.
Физические свойства металлов также отличаются от свойств других элементов. Они обладают высокой теплопроводностью и электропроводностью, что позволяет им передавать тепло и электричество с большой эффективностью. Металлы также обладают высокой пластичностью и прочностью, что делает их идеальными материалами для использования в различных отраслях промышленности и строительства.
Структура атома металлов
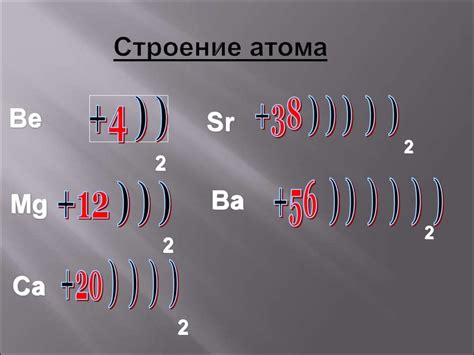
Атом металла представляет собой основную составляющую структурную единицу металлического материала. Он состоит из ядра, окруженного электронами. Ядро атома содержит протоны и нейтроны, а электроны находятся на энергетических уровнях вокруг ядра.
Протоны - это заряженные частицы с положительным зарядом, а нейтроны не несут заряда и являются нейтральными. Ядро металлического атома обладает однозначным числом протонов, которое определяет его атомный номер в периодической таблице.
Электроны, находящиеся вокруг ядра, располагаются на энергетических уровнях или орбитах. Каждый энергетический уровень может вмещать ограниченное количество электронов. Наиболее близкий к ядру уровень вмещает до 2 электронов, следующий уровень - до 8 электронов, а более удаленные уровни могут содержать большее количество электронов.
Атомы металлов обладают своеобразной особенностью - на последнем энергетическом уровне они имеют так называемую валентную зону. В этой зоне находятся свободные электроны, способные участвовать в химических реакциях и формировании связей с другими атомами. Благодаря этой особенности металлы обладают хорошей электропроводностью и теплопроводностью.
Общая характеристика структуры атома металла предоставляет основу для понимания его химических и физических свойств. Именно эта структура определяет, какие элементы могут образовывать металлический материал и какие свойства он будет иметь.
Атомы и их строение

Атом - это наименьшая единица вещества, имеющая все его химические свойства. Он состоит из ядра и электронной оболочки. Ядро содержит протоны, имеющие положительный заряд, и нейтроны, не имеющие заряда. Электронная оболочка состоит из электронов, имеющих отрицательный заряд.
Строение атома вызвало большой интерес у ученых. Благодаря различным экспериментам, были сделаны открытия об основных принципах, на которых основано строение атома. Например, Резерфорд своими опытами доказал, что в атоме есть положительно заряженное ядро и отрицательно заряженные электроны, а электронная оболочка находится на определенном расстоянии от ядра.
Энергетические уровни и оболочки атома играют важную роль в его химических свойствах. Каждый электрон занимает свое энергетическое состояние и может находиться на определенной оболочке. Наиболее близкая к ядру оболочка обладает меньшей энергией, а более удаленная - большей. Энергетические уровни атома помогают объяснить его химическую активность, способность образовывать соединения и проводить электрический ток.
Атомы имеют свойство образовывать молекулы, соединяясь друг с другом. Это происходит благодаря взаимодействию электронов электронных оболочек различных атомов. Подобные связи называют химическими связями. Они определяют химические свойства веществ и являются основой для образования химических соединений.
Химические свойства металлов

Металлы - это класс химических элементов, которые обладают своеобразными химическими свойствами. Они обычно обладают высокой электропроводностью, благодаря свободным электронам, которые могут свободно двигаться в структуре металлической решетки.
Одной из главных химических свойств металлов является их способность образовывать ионы положительного заряда (катионы). Это происходит за счет отдачи электронов во внешнюю электронную оболочку.
Металлы также обладают высокой реакционной способностью и готовностью взаимодействовать с другими веществами. Например, они могут реагировать с кислородом, образуя оксиды. Некоторые металлы, такие как натрий или калий, реагируют с водой, выбирая водород и образуя гидроксид металла. Металлы также способны образовывать соли, взаимодействуя с кислотами.
Помимо этого, металлы обычно обладают свойством термической и электролитической проводимости. Они хорошо проводят тепло и электрический ток, что делает их полезными для различных промышленных и технических целей.
Реакции с кислотами
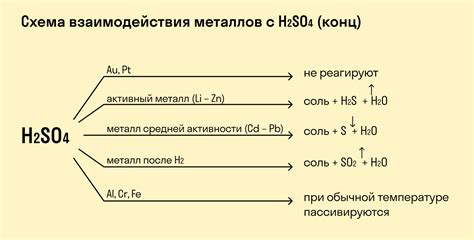
Металлы могут проявлять активность при взаимодействии с кислотами. При этом происходит образование солей и выделение водорода. Причиной этого является способность металлов отдавать электроны и образовывать положительные ионы.
Реакция металлов с кислотами может быть представлена следующим образом: металл + кислота → соль + водород. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водород:
- Zn + 2HCl → ZnCl2 + H2
Некоторые металлы проявляют большую активность при реакции с кислотами. К ним относятся щелочные металлы, такие как натрий и калий. При их взаимодействии с кислотами происходит интенсивное выделение водорода и образование солей. Например, при их реакции с соляной кислотой образуется хлорид натрия (NaCl) или хлорид калия (KCl) и выделяется большое количество водорода:
- 2Na + 2HCl → 2NaCl + H2
- 2K + 2HCl → 2KCl + H2
Реакции металлов с кислотами широко применяются в химической промышленности. Например, их используют для получения солей, таких как хлориды, сульфаты и нитраты, а также для получения водорода, который может быть использован как энергоресурс.
Физические свойства металлов
Металлы - это элементы химического периодического закона, которые обладают определенными физическими свойствами. Одно из основных физических свойств металлов - хорошая теплопроводность. За счет свободного движения электронов, металлы способны эффективно передавать тепло, что делает их идеальными материалами для проводов и радиаторов.
Еще одно важное физическое свойство металлов - высокая теплопроводность. За счет наличия свободно движущихся электронов, металлы могут проводить электрический ток. Благодаря этому свойству металлы широко используются в электродвигателях, проводах и других электрических устройствах.
Кроме того, металлы обладают высокой пластичностью и прочностью. Они могут быть легко обрабатываемыми и принимать различные формы, без разрушения. Это позволяет использовать металлы для создания различных изделий, от машины до строительных конструкций.
Также металлы обладают высокой плотностью и тяжестью, что делает их устойчивыми и надежными материалами для различных приложений. Благодаря этим свойствам, металлы широко используются в авиации, строительстве и машиностроении.
Кроме того, металлы обладают благородной светимостью, что делает их привлекательными для использования в украшениях и ювелирных изделиях. Некоторые металлы, такие как золото и платина, также обладают высокой коррозионной стойкостью, что делает их идеальными для использования в различных условиях.
Проводимость электричества

Металлы являются лучшими проводниками электричества из всех известных веществ. Они обладают высокой электропроводностью благодаря особенностям структуры атома и молекулы. В металлической структуре атомы расположены в решетке, в которой электроны свободно движутся между атомами.
Процесс проводимости электричества в металлах основан на свободном движении электронов. Электрический ток представляет собой поток заряженных частиц – электронов. В металлах, электроны, являясь негативно заряженными частицами, могут свободно передвигаться по кристаллической решетке металла, создавая электрический ток.
Основной фактор, определяющий высокую проводимость металлов, – это наличие свободных или дегенерированных электронов в валентных оболочках атомов. Такие электроны способны свободно двигаться по металлической структуре с минимальными силами сопротивления.
Металлы также обладают высокой теплопроводностью. Это объясняется тем, что при передаче энергии от одного атома к другому в металле основной механизм теплопроводности связан с переносом электронов.
Вопрос-ответ

Какие элементы можно отнести к металлам?
Металлами являются около 80% элементов периодической системы Менделеева. Среди них - железо, алюминий, медь, свинец, цинк, золото, серебро и др.
Каковы основные химические свойства металлов?
Основные химические свойства металлов - ионизация (образование положительных ионов), образование солей, реакция с кислородом, реакция с кислотами, способность образовывать комплексные соединения и другие
Какова структура атома металла?
Атом металла состоит из ядра и электронной оболочки. Ядро состоит из протонов (с положительным зарядом) и нейтронов (нейтральные частицы), а электронная оболочка включает в себя электроны (частицы с отрицательным зарядом).
