Металлы iа и iiiа групп периодической таблицы элементов являются основными металлами и отличаются своими особенностями и свойствами. Группа iа включает самые активные металлы, такие как литий (Li), натрий (Na), калий (K) и др., которые легко реагируют с водой и воздухом. Они обладают низкой плотностью, низкой температурой плавления и высокими электропроводящими свойствами.
Металлы iiiа группы, такие как бор (B), алюминий (Al), галлий (Ga) и др., обладают высокой температурой плавления и являются хорошими проводниками электричества. Они также обладают высокой твёрдостью и прочностью, что делает их полезными материалами в различных отраслях промышленности и техники.
Одним из примеров металлов группы iа является литий (Li), который широко используется в производстве аккумуляторов и взрывчатых веществ. Калий (K) применяется в сельском хозяйстве в качестве удобрения, а натрий (Na) используется в производстве стекла и щелочных металлов. Примерами металлов группы iiiа являются алюминий (Al), который используется в строительстве и производстве авиационных сплавов, и галлий (Ga), который применяется в полупроводниковой и фармацевтической промышленности.
Характеристика металлов ia и iiia групп
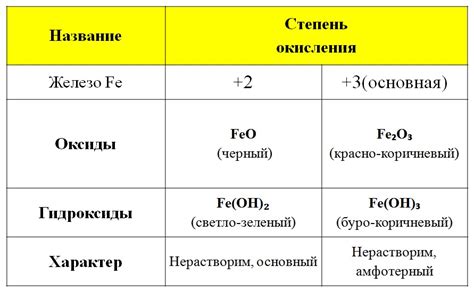
Металлы ia и iiia групп (щелочные и щелочноземельные металлы) характеризуются низкой температурой плавления и высокой электропроводностью. Эти металлы являются активными и легко реагируют с водой и кислородом. Они обладают низкой плотностью и имеют гранулированную структуру. Металлы ia группы имеют мягкую текстуру и могут быть нарезаны ножом, в то время как металлы iiia группы более твердые.
Примеры металлов ia группы: литий, натрий, калий, рубидий, цезий и франций. Эти металлы легко реагируют с водой, образуя щелочные растворы. Они также активно реагируют с кислородом, образуя оксиды. Литий используется в батареях, натрий применяется в производстве стекла, а калий используется в удобрениях.
Примеры металлов iiia группы: бор, алюминий, галлий, индий и таллий. Эти металлы имеют более сложную структуру и обладают повышенной твердостью. Бор является полупроводником и используется в электронике. Алюминий широко применяется в строительстве, благодаря своей легкости и прочности. Галлий и индий используются в полупроводниковой промышленности, а таллий применяется в оптике.
Металлы iа группы: особенности и примеры

Металлы iа группы характеризуются следующими особенностями:
- Наличие одного электрона в внешней оболочке.
- Высокая реакционность и активность.
- Образование ионов с однозначной положительной зарядом.
- Восстановительные свойства.
- Хорошая электропроводность.
В группе iа находятся следующие основные металлы:
- Литий (Li) - мягкий, серебристо-белый металл, наиболее легкий из всех твердых элементов, широко используется в производстве аккумуляторов, керамики и сплавов.
- Натрий (Na) - мягкий, серебристо-белый металл, хорошо растворяется в воде, используется в производстве органических синтезов, пищевой промышленности и в производстве стекла.
- Калий (K) - блестящий серебристо-белый металл, реактивен и сильно реагирует с водой, широко применяется в производстве удобрений и лекарств.
- Рубидий (Rb) - мягкий, серебристо-белый металл, используется в лазерных технологиях, оптике и в исследованиях в области атомных часов.
- Цезий (Cs) - мягкий, золотисто-желтый металл, имеет высокую электропроводность, применяется в исследованиях в области квантовой оптики и в производстве атомных часов.
- Франций (Fr) - самый редкий и радиоактивный металл, применение в различных отраслях науки и техники ограничено из-за его высокой активности и короткого периода полураспада.
Все металлы iа группы являются активными химическими элементами и находят широкое применение в различных отраслях промышленности и научных исследованиях.
Металлы iiiа группы: особенности и примеры

Металлы iiiа группы – это элементы периодической системы, которые относятся к блоку d и внешней электронной оболочкой имеют 3 электрона. Они обладают рядом характеристических особенностей, которые делают их уникальными и широко используемыми в различных отраслях промышленности.
Одной из основных особенностей металлов iiiа группы является их высокая проводимость электрического тока и тепла. Это свойство делает их незаменимыми материалами при создании электрических и тепловых проводников. Металлы iiiа группы также обладают высокой пластичностью и прочностью, что позволяет из них изготавливать различные конструкционные элементы, включая металлические конструкции и инструменты.
Примерами металлов iiiа группы являются алюминий (Al), галлий (Ga) и индий (In). Алюминий – наиболее распространенный металл в этой группе и третий по распространенности в земной коре. Он широко применяется в промышленности, строительстве и быту благодаря своим высоким физическим и химическим свойствам.
Галлий – редкий металл, который обладает низкой температурой плавления и высокой точностью в своих физических свойствах. Он широко используется в производстве полупроводниковых приборов и электротехнических устройств.
Индий – мягкий и деформируемый металл, применяемый в различных отраслях промышленности, включая производство тонкой проволоки, термоэлектрических устройств и покрытий.
Физические свойства металлов iа и iiiа групп
Металлы iа и iiiа групп характеризуются рядом общих физических свойств. В первую очередь, они обладают высокой теплопроводностью и электропроводностью. Это связано с наличием свободных электронов в их структуре, которые способны перемещаться под воздействием внешних факторов.
Еще одной важной характеристикой данных металлов является хорошая пластичность. Они способны легко поддаваться деформации без разрушения и сохранять новую форму после снятия нагрузки. Благодаря этому свойству, их можно легко обрабатывать и применять в различных производственных процессах.
Металлы iа и iiiа групп отличаются высокой плотностью, что делает их тяжелыми материалами. Они также обладают высокой температурой плавления и кипения, что позволяет использовать их в условиях высоких температур и при производстве различных изделий, подверженных воздействию высоких температур.
Примерами металлов iа группы являются литий, натрий, калий, рубидий, цезий и франций. Они обладают ярким металлическим блеском и быстро реагируют с водой, образуя гидроксид металла и выделяя водород. Примерами металлов iiiа группы являются бор, алюминий, галлий, индий и таллий. Они обладают различными особенностями, например, бор является полупроводником, а алюминий имеет легкую массу и хорошо поддается окислению.
Химические свойства металлов IА и IIIА групп
Металлы IА и IIIА групп периодической системы Менделеева обладают сходными химическими свойствами, которые обусловлены наличием одной валентной электронной оболочки.
Во-первых, металлы IА и IIIА групп характеризуются высокой реакционной способностью. Они легко вступают во взаимодействие с кислородом, образуя оксиды, которые могут быть как щелочными, так и основными. Например, натрий вступает в реакцию с кислородом и образует оксид натрия (Na2O), алюминий образует оксид алюминия (Al2O3).
Во-вторых, металлы IА и IIIА групп обладают способностью образовывать соли с кислотами. Это связано с активностью ионов металлов, которые способны давать электроны для образования положительно заряженных ионов. Например, натрий образует соль хлорида натрия (NaCl), алюминий образует соль сульфата алюминия (Al2(SO4)3).
Кроме того, металлы IА и IIIА групп способны образовывать гидроксиды, которые обладают базическими свойствами. Например, натрий образует гидроксид натрия (NaOH), алюминий образует гидроксид алюминия (Al(OH)3).
Изучение химических свойств металлов IА и IIIА групп позволяет получить представление о важности этих элементов в химической промышленности и их широком применении в различных отраслях науки и техники, включая производство сплавов, катализаторов, лекарственных препаратов и многого другого.
Применение металлов iа и iiiа групп в промышленности

Металлы iа и iiiа групп периодической таблицы являются важными материалами для промышленности и имеют широкий спектр применения.
Один из наиболее известных представителей группы iа - натрий (Na). Натрий широко используется в промышленности благодаря своим свойствам, таким как низкая плотность, высокая плотность теплоты, реактивность с кислородом. Он используется при производстве щелочных металлов, протекторов металлических поверхностей, стеклянных изделий и многих других продуктов.
Примером металла iiiа группы является галлий (Ga). Галлий имеет очень низкую точку плавления и высокую плотность, что делает его ценным материалом в промышленности. Он широко применяется в электронике, в производстве полупроводниковых материалов, солнечных батарей и даже в медицине для создания жидкого металла, который используется в термометрах и других медицинских инструментах.
Кроме того, группа iа и iiiа включает такие металлы, как литий (Li), калий (K), магний (Mg) и алюминий (Al), которые находят широкое применение в различных отраслях промышленности. Например, литий используется в производстве аккумуляторов, калий - в производстве удобрений, магний - в автомобильной и авиационной промышленности, алюминий - в производстве конструкционных материалов, а также в производстве различных товаров, от упаковки до электроники.
Таким образом, металлы iа и iiiа групп являются неотъемлемой частью промышленности и находят свое применение во многих отраслях, благодаря своим уникальным химическим и физическим свойствам.
Примеры мировых лидеров по добыче металлов iа и iiiа групп
Примеры мировых лидеров по добыче металлов iа и iiiа групп представляют собой значительные геологические резервы, которые требуют развития различных технологий для их добычи и обработки.
Один из лидеров по добыче металлов iа и iiiа групп – это Россия. Страна занимает одно из ведущих мест в мире по добыче платины, родия, рутения, иридия и осмия – это металлы iа группы. Например, Норильский комбинат – крупнейшая в России и мировая компания по добыче платины и других металлов iа группы.
Другим примером мирового лидера является Южная Африка. Эта страна ведет поставки крупных объемов платины, родия и других металлов iа группы в мировую экономику. В Южной Африке находятся знаменитые россыпи платины, которые обеспечивают значительную долю мировой добычи металлов iа группы.
Казахстан также является заметным игроком в области добычи металлов iа и iiiа групп. Страна имеет значительные запасы хрома, никеля, циркония и редкоземельных металлов, которые относятся к металлам iiiа группы. Крупные месторождения находятся в западной и центральной частях Казахстана и разрабатываются различными компаниями.
Все эти примеры свидетельствуют о значительной роли этих стран в мировой добыче и поставках металлов iа и iiiа групп. Развитие технологий добычи и обработки этих металлов имеет большое значение для экономики этих стран и мировой индустрии в целом.
Экологические аспекты добычи и использования металлов ia и iiia групп
Металлы ia и iiia групп представляют собой важные элементы природы и широко используются в различных отраслях производства. Однако их добыча и использование также имеют негативное воздействие на окружающую среду.
Добыча металлов ia и iiia групп сопровождается значительным воздействием на ландшафт и биологическое разнообразие. К примеру, добыча алюминия, который является элементом ia группы, требует больших объемов энергии и воды, а также приводит к выделению вредных веществ, таких как фториды и сероводород. При разрушении почвы под добычу некоторые металлы могут проникать в подземные воды и загрязнять их.
Использование металлов ia и iiia групп также может иметь негативные последствия для окружающей среды. Например, при использовании алюминиевой фольги или контейнеров для пищевых продуктов, существует риск передачи вредных металлических соединений в пищу. Кроме того, из-за большого количества неиспользованного алюминия возникает проблема его утилизации, что может привести к его скоплению на свалках.
Для уменьшения негативного воздействия на окружающую среду при добыче и использовании металлов ia и iiia групп, необходимо применять современные экологически безопасные технологии. Кроме того, важно проводить регулярные мониторинговые исследования для выявления и предотвращения загрязнения окружающей среды.
- Примеры металлов ia группы: литий, натрий, калий.
- Примеры металлов iiia группы: алюминий, галлий, индий.
В целом, экологические аспекты добычи и использования металлов ia и iiia групп требуют особого внимания и необходимы меры для минимизации их негативного воздействия на окружающую среду.
Вопрос-ответ

Какие особенности отличают металлы группы IA и IIIA?
Металлы группы IA (щелочные металлы) и IIIA (борная группа) обладают некоторыми общими особенностями. Они имеют относительно низкие точки плавления и кипения, хорошую теплопроводность и проводимость электричества. Они также очень реактивны и активно вступают в химические реакции.
Назовите примеры металлов группы IA.
Примерами металлов группы IA являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Какие особенности отличают металлы группы IIIA?
Металлы группы IIIA (борная группа) имеют низкую плотность, низкую температуру плавления и кипения, а также низкую жесткость. Они хорошо проводят тепло и электричество, их реактивность сильно зависит от особенностей внешней электронной оболочки.
Какие металлы относятся к группе IIIA?
К группе IIIA относятся следующие металлы: бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl).
Какие химические реакции могут происходить с металлами группы IA и IIIA?
Металлы группы IA и IIIA активно вступают в химические реакции, включая реакции с водой, кислородом и другими веществами. Например, щелочные металлы группы IA реагируют с водой, выделяя водород и образуя гидроксиды. Металлы группы IIIA могут реагировать с кислородом, образуя оксиды.
