Щелочные металлы – это элементы, которые находятся в первой группе периодической таблицы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы получили свое название из-за своей реактивности с водой, при которой образуется щелочь. Они также известны своей мягкостью и низкой плотностью.
Одно из ключевых свойств щелочных металлов – реактивность. Все щелочные металлы легко реагируют с водой, воздухом и другими веществами. Они обладают высокой аффинностью кислорода, поэтому быстро окисляются и покрываются оксидной пленкой воздуха. Реактивность щелочных металлов растет по группе: литий самый реактивный, а франций самый менее реактивным.
Щелочные металлы имеют низкую плотность и низкую температуру плавления. Они легко растопимы, что делает их идеальными для использования в различных процессах, таких как производство сплавов и легирование других материалов. Кроме того, щелочные металлы обладают способностью образовывать ионы положительного заряда, что делает их хорошими проводниками электричества.
Однако, щелочные металлы имеют и некоторые недостатки. Их реактивность и мягкость делают их чувствительными к окружающей среде, что приводит к быстрой коррозии и потере металлического блеска. Кроме того, они очень реактивны с водой, что делает их опасными для хранения и перевозки.
В целом, щелочные металлы обладают уникальными свойствами и находят широкое применение в различных областях, от электроники до фармацевтики. Изучение и понимание их характеристик помогает нам более эффективно использовать эти ценные материалы.
Свойства щелочных металлов: общая характеристика
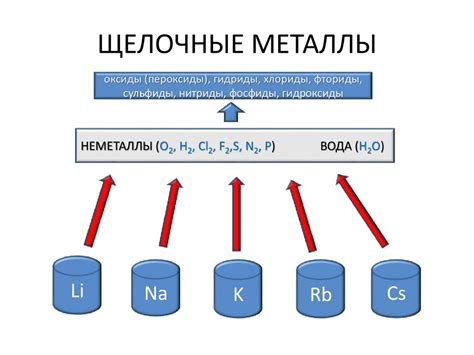
Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили такое название из-за своей способности реагировать с водой, образуя щелочные растворы.
Основные свойства щелочных металлов связаны с их электронной структурой и положением в периодической системе. Они обладают одним электроном в внешней энергетической оболочке, что делает их очень реактивными. Щелочные металлы являются мягкими, низкоплавкими и легкими элементами.
Низкая плотность и малая твердость - одна из основных характеристик щелочных металлов. Так, литий, натрий и калий имеют плотность меньше воды, что делает их очень легкими. Кроме того, щелочные металлы могут быть легко размяты или разрезаны ножом из-за их низкой твердости.
Еще одним важным свойством щелочных металлов является их реактивность с водой. При контакте с водой они образуют щелочные растворы с выделением водорода. Например, натрий реагирует с водой, образуя раствор натрия гидроксида (щелочной раствор) и выделяя водородный газ.
Кроме того, у щелочных металлов есть высокая электропроводность. Так как у них всего один электрон в внешней оболочке, они легко отдают его другим элементам, что делает их хорошими проводниками электричества.
Очень важно отметить, что щелочные металлы обладают высокой реактивностью. Они легко окисляются на воздухе, а также реагируют с многими химическими соединениями. Поэтому они хранятся в специальных ампулах с инертным газом или в масле, чтобы предотвратить их контакт с воздухом и влагой.
Физические свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом характеристических физических свойств, которые делают их уникальными.
Плотность: У щелочных металлов очень низкая плотность. Например, литий является самым легким из всех металлов и обладает плотностью всего около 0,53 г/см³. В то же время, натрий имеет плотность около 0,97 г/см³, а калий - около 0,86 г/см³.
Точка плавления и кипения: У щелочных металлов низкие точки плавления и кипения. Например, натрий плавится при температуре около 97,8 °C, а кипит при 882,9 °C. Калий имеет точку плавления около 63,3 °C и точку кипения около 774 °C.
Мягкость: Щелочные металлы являются очень мягкими и малогабаритными. Они могут быть легко нарезаны ножом или нажаты пальцем. Например, литий мягче свинца, а калий мягче мела.
Оттенок и блеск: Все щелочные металлы имеют оттенок серого или серебристого цвета. Они обладают металлическим блеском и отражают свет.
Реакция с водой: Щелочные металлы активно реагируют с водой, образуя щелочь и выделяя горючий водород. Это свойство наглядно демонстрируется виживанием натрия или калия при погружении их в воду.
Электропроводность: Щелочные металлы являются хорошими проводниками электричества. Они легко переносят заряды и образуют ионы, что делает их ценными в технологии батарей и электрических устройств.
Все эти свойства помогают щелочным металлам находить широкое применение в различных областях, от химической промышленности до производства электроники и батарей.
Химические свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом химических свойств, которые отличают их от других элементов. Они являются самыми активными металлами в периодической системе элементов.
Одной из основных характеристик щелочных металлов является их способность реагировать с водой. При контакте с водой они выделяются водород и образуют щелочные гидроксиды. Эта реакция является очень быстрой и сопровождается выделением большого количества теплоты.
Другой важной химической характеристикой щелочных металлов является их реакционность с кислородом. При контакте с кислородом они образуют оксиды, которые могут быть щелочные или пероксиды. Например, литий образует литиевый пероксид, а натрий образует натриевый пероксид.
Щелочные металлы также проявляют высокую реактивность при взаимодействии с галогенами. Это связано с тем, что они легко отдают свой внешний электрон, образуя ионы с положительным зарядом. При реакции с галогеном они образуют щелочные галогениды.
Важным свойством щелочных металлов является их способность образовывать сплавы с другими металлами. Это обусловлено их высокой металлической активностью и низкой температурой плавления.
Щелочные металлы также обладают способностью образовывать ионные соединения с различными анинами. Это свойство позволяет им образовывать разнообразные соли, которые имеют важное применение в различных отраслях науки и техники.
Важность и применение щелочных металлов в науке и промышленности
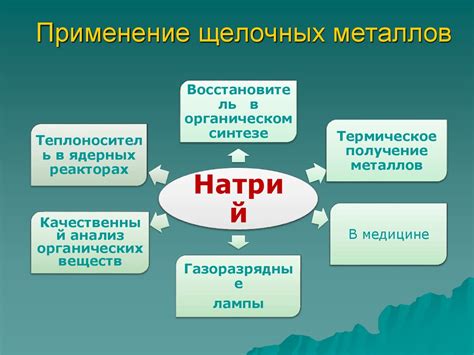
Щелочные металлы, такие как литий, натрий и калий, имеют важное значение в науке и промышленности благодаря своим уникальным свойствам и широкому спектру применений.
Одно из важных применений щелочных металлов в науке – это исследование электрохимических процессов. Литий, например, является ключевым компонентом аккумуляторов и используется в различных электронных устройствах. Натрий и калий используются в исследованиях, связанных с проведением электричества в растворах и в сочетании с другими веществами.
Щелочные металлы также имеют широкое применение в различных промышленных отраслях. Натрий используется в производстве стекла, мыла и моющих средств. Калий важен для производства удобрений, поскольку он содержит необходимые питательные вещества для растений. Литий используется в производстве легких сплавов, лекарственных препаратов и керамических материалов.
Значительная роль щелочных металлов в промышленности также обусловлена их химическими свойствами. Например, щелочные металлы обладают способностью реагировать с водой, выделяя большое количество энергии в процессе. Это свойство используется в химической промышленности для производства взрывчатых веществ и других химических соединений.
Уникальные физические и химические свойства щелочных металлов делают их важными ингредиентами в различных технологических процессах. Их способность проводить электричество, взаимодействовать с другими элементами и формировать стабильные соединения позволяет использовать их в различных сферах науки и промышленности, включая энергетику, электронику, промышленное производство и медицину.
Вопрос-ответ

Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают рядом характерных свойств. Они очень реактивные и активно взаимодействуют с водой, выделяя водород. Это связано с их высокой электроотрицательностью и низкой электронной аффинностью. Также щелочные металлы обладают низкой плотностью, малым температурным расширением и хорошей теплопроводностью.
Какие ионы образуются при растворении щелочных металлов в воде?
При растворении щелочных металлов в воде образуются катионы щелочных металлов (натрия, калия и т.д.) и гидроксидные ионы. Например, при растворении натрия образуются катионы Na+ и анионы OH-. Формула гидроксида натрия - NaOH.
Какие химические свойства характерны для щелочных металлов?
Щелочные металлы обладают химической активностью из-за своей низкой ионизационной энергии и большой электроотрицательности. Они легко реагируют с кислородом, водой, многими неорганическими и органическими соединениями. Например, щелочные металлы образуют хлориды, нитраты, карбонаты и другие соединения.
