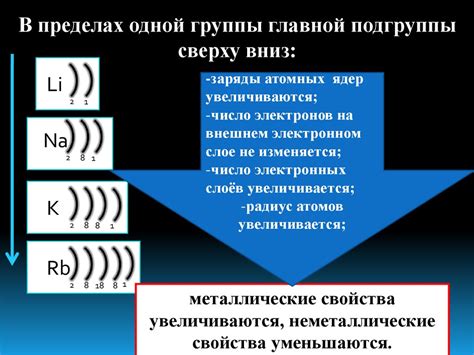
Атомы щелочных металлов - это атомы химических элементов из первой группы периодической системы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы отличаются от всех остальных элементов тем, что их наружная электронная оболочка содержит всего один электрон. Именно этот электрон обладает особыми свойствами и влияет на химические и физические характеристики этих элементов.
На внешнем энергетическом уровне атомов щелочных металлов находится один электрон, с которым связано множество интересных особенностей. Уровень имеет значение n=2 и обозначается как s-орбиталь. Этот электрон является наиболее доступным для реакций и взаимодействия с другими атомами. Благодаря этому, щелочные металлы обладают высокой реакционной способностью и являются мощными веществами в химии.
Примечательно, что атомы щелочных металлов стремятся избавиться от своего единственного электрона на внешнем энергетическом уровне. Они готовы его передать другим атомам, чтобы достичь наиболее стабильного состояния. Поэтому щелочные металлы легко формируют ионы положительного заряда и играют важную роль в образовании соединений и реакциях окисления-восстановления.
Внешний энергетический уровень атомов щелочных металлов также влияет на их физические свойства, в том числе на металлические свойства. Электрон на этом уровне обладает высокой подвижностью и легко перемещается между атомами. Это делает щелочные металлы отличными проводниками электричества и тепла. Кроме того, электрон на внешнем уровне волокнистым образом связан с положительно заряженным ядром, что объясняет низкую температуру плавления и кипения щелочных металлов.
Внешний энергетический уровень: структура и его особенности
Внешний энергетический уровень атомов щелочных металлов представляет собой наружный электронный слой, на котором находятся электроны, не связанные с ядром атома. Он является самым далеким от ядра и наиболее доступным для взаимодействия с другими атомами и молекулами.
Структура внешнего энергетического уровня щелочных металлов характеризуется тем, что на этом уровне может находиться только один электрон. Однако, этот электрон имеет высокую энергию и стабильность, что обуславливает активность и химические свойства щелочных металлов.
На внешнем энергетическом уровне электрон находится в s-подуровне. Он обладает наименьшей энергией среди всех электронных подуровней. Это позволяет щелочным металлам образовывать легко ионизируемые ионные соединения.
Особенностью внешнего энергетического уровня атомов щелочных металлов является их склонность к потере одного электрона при взаимодействии с другими элементами. Это связано с тем, что атомы щелочных металлов стремятся достичь электронной конфигурации инертного газа - иметь полностью заполненный внешний энергетический уровень.
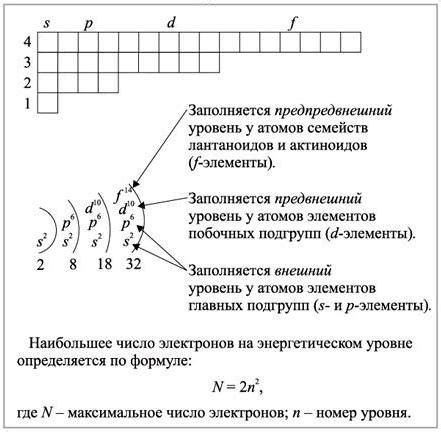
Внешний энергетический уровень атомов щелочных металлов: определение и функции

Внешний энергетический уровень атома – это энергетический уровень, расположенный на самой внешней оболочке атома, на котором находятся электроны с наибольшей энергией. Для атомов щелочных металлов такой внешний энергетический уровень находится на s-подуровне.
Атомы щелочных металлов, таких как литий, натрий, калий и другие, имеют один электрон на своем внешнем энергетическом уровне. Этот электрон с наибольшей энергией называется валентным электроном и определяет химические свойства атома.
Функции внешнего энергетического уровня атомов щелочных металлов включают:
- Участие в химических реакциях: благодаря валентным электронам атомы щелочных металлов могут образовывать ионные связи с другими атомами, образуя соединения с различными элементами.
- Образование химических соединений: электроны на внешнем энергетическом уровне металла могут участвовать в образовании межатомных связей, что позволяет атомам щелочных металлов формировать кристаллическую решетку в их металлических соединениях.
- Определение реакционной способности: наличие одного валентного электрона на внешнем энергетическом уровне даёт атомам щелочных металлов большую реакционную способность и способность образовывать стабильные ионы с отрицательным зарядом.
- Участие в электропроводности: валентные электроны, находящиеся на внешнем энергетическом уровне, могут свободно перемещаться в легированных кристаллах металлов, обеспечивая электрическую проводимость.
В целом, внешний энергетический уровень атомов щелочных металлов играет важную роль в их химических свойствах и обуславливает их активное взаимодействие с другими элементами.
Организация электронного оболочки на внешнем энергетическом уровне
Внешний энергетический уровень атомов щелочных металлов является самым высокоэнергетическим уровнем в их электронной оболочке. Он состоит из одного электрона, расположенного на последней оболочке атома, называемой валентной оболочкой.
Электрон на внешнем энергетическом уровне называется валентным электроном и он играет ключевую роль в химических реакциях элементов. Валентный электрон обладает свободным состоянием, то есть он может участвовать в образовании химических связей с другими атомами, что позволяет атомам щелочных металлов образовывать стабильные соединения.
Валентные электроны на внешнем энергетическом уровне образуют электронную оболочку, которая может быть представлена в виде электронной формулы элемента. Например, у атома лития на внешнем энергетическом уровне находится один электрон, поэтому его электронная формула будет выглядеть как 1S1. У атома натрия на внешнем энергетическом уровне находится один электрон, на следующем энергетическом уровне расположено восемь электронов. Поэтому электронная формула натрия будет выглядеть как 2S22P63S1.
Стоит отметить, что валентные электроны на внешнем энергетическом уровне могут быть вовлечены в химические реакции, например, при образовании ионов или образовании ковалентных связей. Также, они могут быть подвержены внешнему воздействию, что вызывает переход электрона на другой энергетический уровень или его удаление из атома.
Особенности внешнего энергетического уровня у атомов щелочных металлов

Щелочные металлы – это химические элементы из первой группы периодической таблицы, такие как литий, натрий, калий и др. Они обладают общей особенностью – наличием одного электрона на своем внешнем энергетическом уровне, что делает их крайне реакционоспособными.
Этот один свободный электрон делает атомы щелочных металлов очень активными в химических реакциях. Они легко отдают свой внешний электрон, что приводит к образованию ионов положительного заряда. Такое отдача электрона осуществляется с целью достижения стабильного, полностью заполненного внешнего энергетического уровня.
Атомы щелочных металлов в основном образуют ионы одновалентного положительного заряда. Присутствие одного электрона на внешнем уровне позволяет им легко формировать ионы такого заряда, так как им нужно лишь отдать или приобрести один электрон.
Такая реакционная способность атомов щелочных металлов делает их важными элементами во многих сферах, включая производство сплавов, проведение электролиза и использование в реакциях, связанных с производством электроэнергии. Благодаря своим уникальным химическим свойствам, щелочные металлы играют важную роль в различных процессах и технологиях нашей жизни.
Роль внешнего энергетического уровня в химических реакциях щелочных металлов
Внешний энергетический уровень атомов щелочных металлов играет важную роль в химических реакциях этих элементов. Щелочные металлы (литий, натрий, калий и др.) характеризуются наличием одного электрона на своем внешнем энергетическом уровне. Этот электрон является главным актором во всех их химических реакциях и определяет их особенности.
Внешний энергетический уровень атома щелочного металла содержит одну энергетическую оболочку, обозначаемую символом s. На этом уровне находится один электрон. Из-за слабой силы притяжения ядра, этот электрон относительно легко отделяется от атома, что делает щелочные металлы хорошими веществами для термических и электрохимических процессов.
Внешний энергетический уровень атомов щелочных металлов становится тем центром внимания, с которым возникают химические реакции. Он часто участвует в обмене ионами и электронами с другими элементами, что позволяет щелочным металлам проявлять активность в различных реакциях.
Наличие одного электрона на внешнем энергетическом уровне у щелочных металлов позволяет им легко образовывать ионы, отдавая этот электрон или принимая один дополнительный электрон. Такие реакции обычно сопровождаются выделением энергии, что объясняет высокую реакционную способность щелочных металлов. Благодаря этому свойству, атомы щелочных металлов нестабильны и склонны образовывать химические соединения с другими элементами.
Значение изучения внешнего энергетического уровня атомов щелочных металлов

Внешний энергетический уровень атомов щелочных металлов играет значительную роль в понимании их физических и химических свойств. Он определяет поведение и реакционную способность этих элементов, а также их способность образовывать соединения с другими элементами.
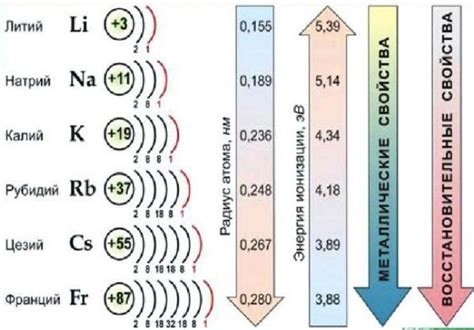
Изучение внешнего энергетического уровня позволяет понять, почему щелочные металлы обладают низкой ионизационной энергией и высокой электроотрицательностью. Высокая электроотрицательность делает щелочные металлы реакционно активными, что проявляется в их способности образовывать сильные щелочные растворы и реагировать с многими веществами, включая воду.
Важное значение имеет также способность щелочных металлов образовывать ионы с положительным зарядом. Она основывается на возможности атома щелочного металла потерять один электрон, перейти на более низкий энергетический уровень и образовать положительный ион. Изучение внешнего энергетического уровня позволяет определить энергию, необходимую для образования и удерживания ионов щелочных металлов в растворах или кристаллических решетках.
Внешний энергетический уровень атомов щелочных металлов также влияет на их способность образовывать соединения с другими элементами, в том числе неметаллами. Понимание взаимодействия этих элементов на основе изучения внешнего энергетического уровня позволяет предсказывать реактивность щелочных металлов и использовать их в различных сферах, включая химическую промышленность и энергетику.
В целом, изучение внешнего энергетического уровня атомов щелочных металлов важно для понимания их химических свойств и реакционной способности. Оно позволяет предсказывать и изучать их взаимодействие с другими элементами и создавать новые материалы с уникальными свойствами.
Вопрос-ответ

Какова структура внешнего энергетического уровня атомов щелочных металлов?
Структура внешнего энергетического уровня атомов щелочных металлов характеризуется наличием одного электрона на этом уровне. Внешний уровень обладает s-образной формой и состоит из одной s-орбитали, которая является одним из подуровней основного энергетического уровня. Это делает атомы щелочных металлов обладателями высокой химической активности и готовыми легко отдавать этот электрон во внешнюю оболочку при соединении с другими атомами.
Какие особенности имеет внешний энергетический уровень атомов щелочных металлов?
Внешний энергетический уровень атомов щелочных металлов имеет ряд особенностей. Во-первых, он содержит одну s-орбиталь, что позволяет этим атомам быть очень активными химическими элементами. Во-вторых, все атомы щелочных металлов ведут себя аналогично в химических реакциях, так как у них одна и та же конфигурация внешнего энергетического уровня. В-третьих, именно благодаря внешнему энергетическому уровню, атомы щелочных металлов проявляют свои металлические свойства, такие как хорошая электропроводность и термическая проводимость.
