Соли щелочных металлов являются наиболее распространенным классом неорганических химических соединений. Они образуются путем реакции щелочных металлов с неорганическими и органическими кислотами. Общая формула солей щелочных металлов позволяет описать химическую структуру этих соединений и прогнозировать их свойства.
Формула солей щелочных металлов имеет следующий вид: MX, где M обозначает щелочной металл (либо натрий, либо калий, либо рубидий, либо цезий, либо франций), а X - анион (кислотный остаток), который определяется кислотой, используемой для синтеза соли. Кислотные остатки могут быть разными (например, хлор, бром, йод, сульфат, нитрат и др.), что влияет на свойства и применение солей щелочных металлов.
Примеры солей щелочных металлов: нитрат натрия (NaNO3), хлорид калия (KCl), бромид рубидия (RbBr).
Основные свойства солей щелочных металлов связаны с ионными связями, которые образуются между положительно заряженными ионами щелочных металлов и отрицательно заряженными ионами кислотного остатка. Благодаря этой структуре, соли щелочных металлов обладают высокой растворимостью в воде, а также хорошей электропроводностью.
Состав солей щелочных металлов

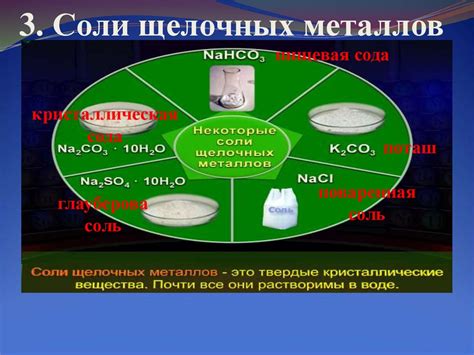
Соли щелочных металлов являются соединениями, в состав которых входят ионы щелочного металла и отрицательные радикалы. Они обладают общей формулой M(X), где М - металл, а X - отрицательный радикал.
Щелочные металлы включают в себя элементы первой группы периодической системы - литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Соли щелочных металлов широко используются в различных отраслях науки и промышленности.
Одним из наиболее распространенных типов солей щелочных металлов являются хлориды. Например, хлорид натрия (NaCl) и хлорид калия (KCl) широко применяются в пищевой промышленности и в медицине. Они обладают соленым вкусом и хорошо растворяются в воде.
Кроме хлоридов, соли щелочных металлов могут содержать и другие отрицательные радикалы. Например, сульфаты, карбонаты, нитраты, фосфаты и другие. Они имеют различные свойства и также находят применение в различных сферах жизни.
Важно отметить, что соли щелочных металлов обладают высокой растворимостью в воде и хорошей проводимостью электрического тока. Их свойства и возможности применения делают их неотъемлемой частью многих технологических процессов и научных исследований.
Применение солей щелочных металлов

Соли щелочных металлов – это химические соединения, которые имеют широкое применение в различных сферах жизни. Они находят применение как в промышленности, так и в научных исследованиях, а также в бытовых целях.
Одним из основных применений солей щелочных металлов является использование их в производстве стекла. Калийные и натриевые соли используются для придания стеклу определенных свойств, таких как прозрачность, твердость и устойчивость к температурным изменениям. Кроме того, соли щелочных металлов применяются при производстве различного рода солнечных батарей, электродов и других электронных устройств.
Еще одним важным применением солей щелочных металлов является их использование в пищевой промышленности. Например, натриевые и калиевые соли используются в качестве консервантов, а также для придания определенного вкуса и аромата пищевым продуктам. Они также играют важную роль в регулировании кислотности и основности пищи.
Соли щелочных металлов также широко применяются в медицине, особенно в фармацевтической отрасли. Они используются для производства лекарственных препаратов, а также в качестве компонентов пищевых добавок. Калийные соли, например, применяются для лечения сердечных заболеваний, а натриевые соли – для восстановления уровня электролитов в организме.
В исследовательских целях соли щелочных металлов также находят широкое применение. Они используются для получения образцов соединений, изучения их свойств и реакций. Калийные и натриевые соли особенно популярны в этой области, так как они легко растворяются в воде и образуют стабильные растворы.
Итак, соли щелочных металлов играют важную роль в различных сферах жизни. Они применяются в производстве стекла, в пищевой промышленности, в медицине и в научных исследованиях. Они обладают уникальными свойствами, которые позволяют им использоваться во многих процессах и придавать определенные свойства различным материалам и продуктам.
Способы получения солей щелочных металлов
Соли щелочных металлов, таких как литий, натрий, калий и др., широко используются в различных отраслях промышленности и научных исследованиях. Получение этих солей может осуществляться с использованием различных способов.
Одним из наиболее распространенных способов получения солей щелочных металлов является реакция металла с кислотой. В результате этой реакции образуется соль и выделяется водород. Например, при реакции натрия с серной кислотой получается сульфат натрия и выделяется водород газ.
Еще одним способом получения солей щелочных металлов является нейтрализационная реакция. В этом случае раствор соли получают путем соединения растворов кислоты и щелочи. Например, при нейтрализации раствора хлороводородной кислоты (HCl) раствором гидроксида натрия (NaOH) образуется хлорид натрия (NaCl) и вода.
Также соли щелочных металлов можно получить методом двойного обмена. При этом реакции происходит обмен ионов между двумя солями. Например, при смешивании растворов хлорида калия (KCl) и нитрата натрия (NaNO3) образуется хлорид натрия (NaCl) и нитрат калия (KNO3).
Важно отметить, что способ получения солей щелочных металлов может зависеть от их конкретного типа и предназначения. Некоторые соли могут быть получены только с использованием специальных технологий и оборудования. Поэтому выбор способа получения соли должен осуществляться с учетом требований конкретного процесса или исследования.
Особенности реакций солей щелочных металлов
В химии соли щелочных металлов представляют собой важный класс соединений, которые обладают рядом особенностей при взаимодействии. Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), а их соли широко используются в различных отраслях науки и техники.
Одной из основных особенностей реакций солей щелочных металлов является их высокая растворимость в воде. В результате растворения солей в воде происходит диссоциация, то есть разделение ионов на положительно заряженные катионы и отрицательно заряженные анионы. Наиболее распространенными анионами солей щелочных металлов являются гидроксиды (OH(-)) и хлориды (Cl(-)).
Реакции солей щелочных металлов с кислотами также имеют свои специфические особенности. При взаимодействии щелочных металлов с кислотами происходит образование соли и воды. Эта реакция называется нейтрализацией. Соли, образующиеся в результате нейтрализационных реакций щелочных металлов с кислотами, обладают различными свойствами и могут быть использованы в различных сферах деятельности человека.
Также стоит отметить, что соли щелочных металлов могут образовывать кристаллические структуры разной формы и размера. Кристаллическая структура солей зависит от взаимодействия частиц вещества и их упорядоченности. Кристаллы солей щелочных металлов часто обладают кубической или гексагональной формой и образуются в результате долгого процесса охлаждения растворов или испарения воды.
Вопрос-ответ

Какая общая формула солей щелочных металлов?
Общая формула солей щелочных металлов имеет вид MX, где М обозначает щелочной металл, а X – анион.
Какие ионы содержат соли щелочных металлов?
Соли щелочных металлов содержат положительные ионы щелочных металлов (натрия, калия, рубидия, цезия, франция) и отрицательные ионы анионов, которые зависят от природы кислоты, используемой для получения соли.
Какая общая формула солей натрия?
Общая формула солей натрия имеет вид NaX, где X - анион. Примеры солей натрия включают хлорид натрия (NaCl), карбонат натрия (Na2CO3), нитрат натрия (NaNO3) и другие.
Какие есть примеры солей щелочных металлов?
Примеры солей щелочных металлов включают хлорид натрия (NaCl), сульфат калия (K2SO4), нитрат рубидия (RbNO3), фосфат цезия (Cs3PO4) и многие другие.
