Оксиды с металлами являются одной из основных групп химических соединений. Они образуются при взаимодействии металлов с кислородом и представляют собой соединения, в которых кислород связан с металлом. Общая формула оксидов с металлами выглядит как MO, где М - символ металла. При этом, оксиды с металлами могут иметь различные степени окисления металла, что влияет на их свойства и функции.
Оксиды с металлами имеют широкое применение в различных областях, таких как металлургия, электроника, катализ и другие. Некоторые оксиды с металлами обладают не только химической активностью, но и специфическими физическими свойствами, такими как проводимость электричества или магнитные свойства.
Примерами оксидов с металлами являются оксид железа (FeO), оксид алюминия (Al2O3), оксид меди (CuO), оксид цинка (ZnO) и др. Каждый оксид с металлом имеет свою уникальную структуру и свойства, которые определяются не только степенью окисления металла, но и его химической природой.
Формула оксидов с металлами: основные принципы и примеры

Оксиды являются неорганическими соединениями, состоящими из металла и кислорода. Основной принцип формирования формулы оксида металла заключается в балансировке зарядов элементов.
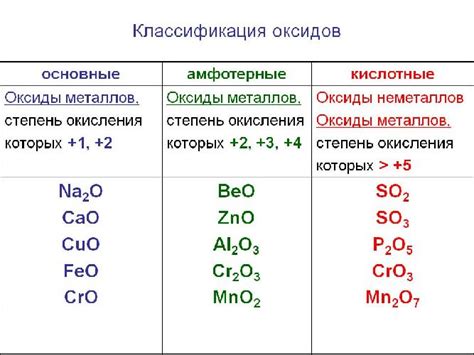
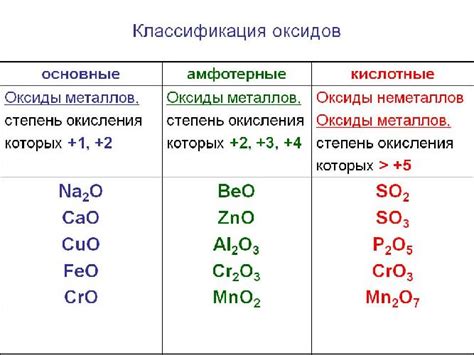
Оксиды металлов могут быть двух типов: основные и кислотные. Основные оксиды обладают щелочными свойствами и растворяются в воде, образуя гидроксиды металлов. Кислотные оксиды, напротив, проявляют кислотные свойства и при контакте с водой образуют соответствующие кислоты.
Примеры оксидов с металлами:
- Оксид железа (Fe2O3) - основной оксид железа, образующийся при окислении металла в присутствии кислорода.
- Оксид алюминия (Al2O3) - часто встречающийся кристаллический оксид алюминия, используемый в промышленности и строительстве.
- Оксид меди (CuO) - кислотный оксид меди, обладающий примечательными свойствами в качестве катализатора и пигмента.
Формула оксидов с металлами может варьироваться в зависимости от степени окисления металла. При изучении химических свойств оксидов металлов важно учитывать их структуру и влияние на реактивность их соединений в различных условиях.
Оксиды: определение и свойства

Оксиды - это неорганические соединения, состоящие из атомов металла и кислорода. Они обладают широким спектром свойств и имеют важное значение в химии и технологии. Структура оксидов может быть ионная или молекулярная.
Важным свойством оксидов является их химическая активность. Они могут проявлять окислительные или восстановительные свойства. Некоторые оксиды могут быть растворимыми в воде, а другие нерастворимыми.
Постижение свойств оксидов позволяет предсказывать их взаимодействия с другими соединениями и применять их в различных областях. Оксиды используются в производстве металлов, стекла, керамики, синтезе органических соединений и многих других процессах.
Некоторые примеры оксидов включают оксиды железа, алюминия, кальция, магния и многие другие. Они имеют разные физические и химические свойства, что делает их полезными в различных областях науки и промышленности.
Основные принципы образования оксидов
Оксиды с металлами - это такие химические соединения, в которых металл соединяется с кислородом. Формула оксида металла обычно состоит из символов металла и кислорода, где кислород обычно имеет знак "O", а металл обозначается его символом.
Основными принципами образования оксидов с металлами являются:
- Ионное связывание: оксиды металлов образуются за счет взаимодействия положительно заряженных ионов металла и отрицательно заряженных ионов кислорода.
- Закон сохранения заряда: суммарный заряд ионов в оксиде должен быть равным нулю. Это означает, что количество ионов металла должно быть равно количеству ионов кислорода, чтобы обеспечить нейтральность соединения.
- Энергия образования: процесс образования оксидов сопровождается выделением или поглощением энергии. Как правило, образование оксидов является экзотермическим процессом, то есть сопровождается выделением тепла.
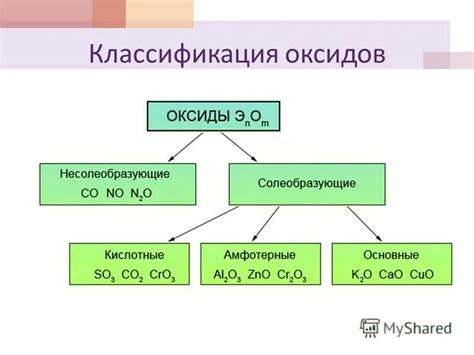
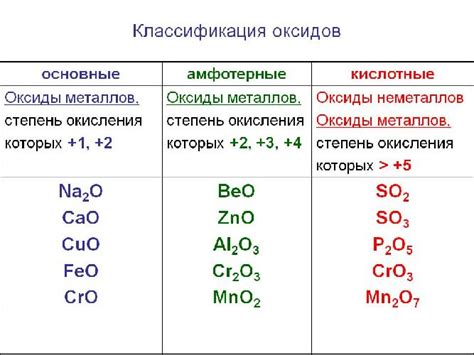
- Тип оксида: оксиды металлов могут быть кислотными, основными или амфотерными, в зависимости от их химических свойств. Кислотные оксиды реагируют с водой, образуя кислоты, основные оксиды реагируют с водой, образуя щелочи, а амфотерные оксиды могут проявлять как кислотные, так и основные свойства, взаимодействуя как с кислотами, так и с щелочами.
Важно отметить, что металлы могут образовывать различные оксиды с разными степенями окисления, что влияет на их химические свойства и применение. Например, железо может образовывать оксиды FeO, Fe2O3 и Fe3O4, которые обладают разными цветами и растворимостью.
Типы оксидов с металлами
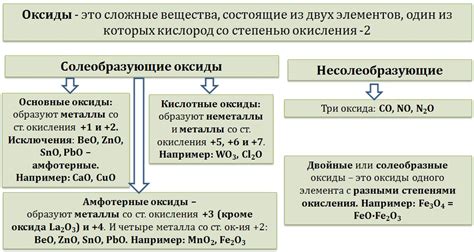
1. Основные оксиды: Эти оксиды образуются в результате сочетания металлов с кислородом при высоких температурах. Они характеризуются активной реакцией с водой, образуя гидроксиды. Примерами основных оксидов являются оксиды щелочных и щелочноземельных металлов.
2. Кислотные оксиды: Эти оксиды образуются при соединении неметаллов с кислородом. Они могут растворяться в воде и образовывать кислоты. Примерами кислотных оксидов являются диоксид серы (SO2) и диоксид углерода (CO2).
3. Амфотерные оксиды: Эти оксиды могут проявлять как основные, так и кислотные свойства. Они могут взаимодействовать как с кислотами, так и с основаниями. Примерами амфотерных оксидов являются оксиды алюминия и цинка.
4. Нейтральные оксиды: Эти оксиды не образуют ни кислоты, ни основания. Они характеризуются отсутствием реакции с водой. Примерами нейтральных оксидов являются оксид железа (Fe3O4) и оксид кремния (SiO2).
5. Перекисные оксиды: Эти оксиды содержат в своей составной молекуле атомы кислорода в степени окисления -1. Примером перекисного оксида является пероксид водорода (H2O2).
Таким образом, оксиды с металлами могут быть разных типов: основные, кислотные, амфотерные, нейтральные и перекисные, каждый из которых обладает своими уникальными свойствами и реактивностью.
Оксиды лёгких металлов: свойства и примеры
Следуя общей формуле, в оксидах лёгких металлов составляющей главную роль играет кислород. Они образуются при реакции металлов с кислородом, их оксидацией. Стоит отметить, что лёгкими металлами называются металлы с низкой плотностью и низкой температурой плавления, такие как натрий, калий, литий и другие.
Оксиды лёгких металлов обладают рядом характерных свойств, среди которых:
- белый цвет;
- решетчатая структура;
- часто являются летучими веществами;
- имеют высокую химическую активность;
- обладают щелочными свойствами, растворяются в воде, образуя гидроксиды;
- могут выдавать кислород при нагревании или при взаимодействии с кислотами.
Примерами оксидов лёгких металлов являются:
- Оксид натрия (Na2O) - белый кристаллический порошок, растворяется в воде с образованием щелочной среды;
- Оксид калия (K2O) - белый порошок с высокой реактивностью, растворяется в воде и образует гидроксид калия;
- Оксид магния (MgO) - белый порошок, высоко термоустойчив, используется в производстве огнеупорных материалов;
- Оксид лития (Li2O) - является летучим веществом, используется в электрохимии.
Таким образом, оксиды лёгких металлов характеризуются своеобразными свойствами, и их примеры подтверждают их широкое использование в различных отраслях науки и техники.
Оксиды переходных металлов: особенности и примеры
Переходные металлы характеризуются наличием переменного валентности, что отражается и в свойствах их оксидов. Оксиды переходных металлов обладают разнообразными структурами и свойствами, что делает их важными веществами в различных областях науки и промышленности.
Одной из особенностей оксидов переходных металлов является переменная степень окисления металла, что отражается в формуле оксида. Например, оксид железа может иметь формулу FeO (оксид железа(II)) или Fe2O3 (оксид железа(III)). Это связано с тем, что переходные металлы имеют несколько вариантов энергетических уровней электронов, что позволяет им образовывать различные соединения с кислородом.
Оксиды переходных металлов обладают различными свойствами. Например, оксид меди (CuO) является твердым веществом с черным цветом, хорошо растворяется в кислотах и реагирует с аммиаком. Оксид кобальта (CoO) также является твердым веществом, но имеет серый цвет и используется в производстве магнитов и катализаторов.
Оксиды переходных металлов находят широкое применение в различных отраслях. Например, оксид титана (TiO2) применяется в производстве красок, пигментов и солнечных батарей. Оксиды железа широко используются в производстве стали, нефтепродуктов и магнитных материалов. Оксиды переходных металлов являются важными объектами исследований в области катализа, электрохимии и других отраслях химии.
Оксиды щелочноземельных металлов: принципы образования и примеры

Оксиды щелочноземельных металлов - это соединения, образующиеся в результате реакции щелочноземельных металлов с кислородом. Они являются классом неорганических соединений, в которых металл связан с кислородом.
Формула оксидов щелочноземельных металлов обычно записывается в виде MO, где M — металл, а O — кислород. Таким образом, для каждого щелочноземельного металла существует свой специфический оксид.
Примеры оксидов щелочноземельных металлов:
- Оксид кальция (CaO), который известен также под названием известь. Он получается путем обжига известняка и широко используется в строительной и химической промышленности.
- Оксид магния (MgO), который называется также магнезией. Он обладает высокой термической и химической стойкостью, и часто применяется в производстве огнеупорных материалов.
- Оксид бария (BaO), который имеет широкое применение в производстве скопления и радиоэлектронике.
Оксиды щелочноземельных металлов являются основными оксидами, то есть они образуют растворы, способные реагировать с кислотами. При реакции с водой они образуют гидроксиды щелочноземельных металлов.
Таким образом, оксиды щелочноземельных металлов играют важную роль в различных областях промышленности и науки, и их свойства определяются химическим составом и структурой, а также условиями их образования.
Оксиды щелочных металлов: свойства и примеры
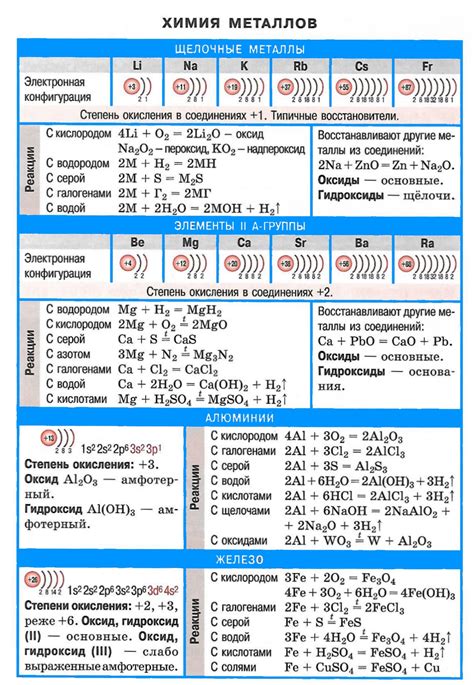
Оксиды щелочных металлов – это соединения, состоящие из атомов щелочных металлов (например, натрия, калия, лития и др.) и кислорода. Они обладают рядом характерных свойств, что делает их важными в химической промышленности и науке.
Оксиды щелочных металлов обычно обладают высокой электроотрицательностью и формируют сильные щелочные растворы. Они растворяются в воде, образуя гидроксиды соответствующих металлов, что делает их основаниями. Благодаря этим свойствам, оксиды щелочных металлов широко применяются в производстве щелочей, стекла, косметики, моющих средств и других промышленных продуктов.
Одним из наиболее известных оксидов щелочных металлов является оксид натрия (Na2O), больше известный как сода. Он широко используется в пищевой и стекольной промышленности. Другим примером является оксид калия (K2O), который находит применение в производстве удобрений и стекла.
Оксиды щелочных металлов также можно использовать в качестве катализаторов в химических реакциях и в процессе синтеза различных соединений. Они обладают хорошей электропроводностью и используются в производстве электролитических ячеек, аккумуляторов и других устройств, работающих на основе электролиза.
В целом, оксиды щелочных металлов являются важными соединениями с широким спектром применения в различных сферах науки и промышленности. Их свойства и примеры их использования помогают понять роль этих соединений в химии и повседневной жизни.
Оксиды редкоземельных металлов: особенности и примеры
Оксиды редкоземельных металлов - это соединения, состоящие из кислорода и металла, образующиеся в результате окисления металлов. Эти металлы являются ценными и широко используемыми в промышленности, поскольку обладают уникальными химическими и физическими свойствами.
Особенностью оксидов редкоземельных металлов является их способность образовывать структуры с различными типами кристаллической решетки. Некоторые оксиды имеют пирохлоровую или флюоритовую структуру, другие - перовскитовую или рутиловую. Эти структуры обусловливают множество интересных физических и химических свойств оксидов.
Примером редкоземельного оксида является оксид циркония (ZrO2), который имеет стабильную кристаллическую структуру типа флюорита. Он обладает высокой степенью твердости, термостабильностью и стойкостью к коррозии, что делает его ценным материалом для производства керамики, лазерных кристаллов и других высокотехнологичных изделий.
Другим примером является оксид самария (Sm2O3), который имеет структуру типа пирохлора. Он обладает ферромагнитными свойствами и используется в изготовлении магнитов, специальных керамических материалов и электронных компонентов.
Таким образом, оксиды редкоземельных металлов представляют собой важный класс соединений, обладающих уникальными свойствами и находящих широкое применение в различных отраслях промышленности.
Вопрос-ответ

Какая общая формула оксидов с металлами?
Общая формула оксидов с металлами обычно имеет вид MxOy, где M - символ металла, x и y - целые числа, обозначающие соотношение количества атомов металла и кислорода в соединении.
Каковы принципы образования оксидов с металлами?
Образование оксидов с металлами основано на реакции металла с кислородом. В результате реакции, атомы металла образуют соединение с кислородом. Число атомов кислорода в оксиде зависит от степени окисления металла.
Можно ли привести примеры оксидов с металлами?
Да, конечно. Некоторые примеры оксидов с металлами: гидроксид натрия (NaOH), оксид кальция (CaO), оксид железа (Fe2O3) и оксид алюминия (Al2O3).
