Щелочные металлы, которые находятся в первой группе периодической системы, включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реактивностью и активностью, что связано с особенностями их электронной структуры. Общая электронная формула щелочных металлов помогает понять основные закономерности и свойства этих элементов.
Электронная формула атома щелочного металла обычно записывается в виде ns¹, где n - номер главной энергетической оболочки, а ¹ - количество электронов на данной оболочке. Например, у лития 2 электрона на первой энергетической оболочке, поэтому его электронная формула будет Li(2¹).
Электронная формула позволяет определить количество электронов во внешней оболочке атома щелочного металла, что играет ключевую роль в его химической активности. У всех щелочных металлов внешняя оболочка содержит 1 электрон, что делает их ионами с положительным зарядом +1. Это связано с тем, что внешний электрон самый слабосвязанный и удаляется сравнительно легко. Поэтому щелочные металлы легко образуют ионы, уступая свой внешний электрон другим элементам.
Основы электронной структуры

Электронная структура атомов щелочных металлов определяется расположением и движением электронов вокруг ядра. Электроны располагаются на различных энергетических уровнях и образуют электронные оболочки.
Каждый атом щелочного металла имеет один электрон в самой внешней энергетической оболочке, так называемом s-орбитале. Этот электрон является валентным электроном и ответственен за химические свойства щелочных металлов.
Электронная структура атома щелочных металлов может быть представлена в виде электронной формулы, которая показывает количество электронов на каждом энергетическом уровне. Например, для лития электронная формула будет: 1s2 2s1, что означает наличие 2 электронов в первой энергетической оболочке и 1 электрона во второй энергетической оболочке. Подобные формулы позволяют легко определить электронную структуру и расположение валентных электронов в атоме щелочных металлов.
Знание основ электронной структуры атомов щелочных металлов является важным для понимания и объяснения их химических свойств и реакций. Электронная структура определяет, как атомы щелочных металлов взаимодействуют с другими атомами в химических соединениях и какие свойства проявляются при этом.
Что такое электронная структура атома?
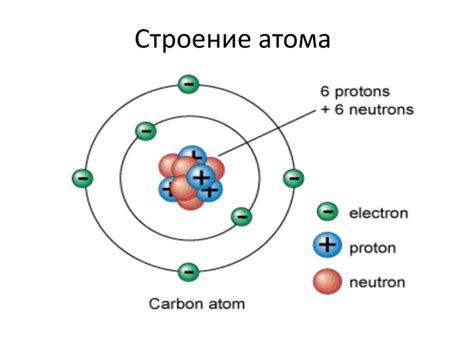
Электронная структура атома - это распределение электронов в энергетических уровнях вокруг атомного ядра. Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, в то время как электроны обращаются вокруг него.
Электроны имеют отрицательный электрический заряд и обладают массой, которая ничтожно мала по сравнению с протонами и нейтронами. Они различаются по энергетическим уровням, обозначаемым как K, L, M и т. д. каждый с определенным количеством электронных подуровней s, p, d, f.
Количество электронов в оболочке противостоит числу элементов в группе в таблице Менделеева, что помогает понять и предсказать свойства и поведение атомов в периодической системе элементов.
Электронная структура атома подразумевает также полный или неполную заполненность электронных подуровней. Атом с полностью заполненной электронной оболочкой называется инертным, а атомы, у которых неполностью заполнены электронные подуровни, имеют склонность к образованию ионов и реакциям с другими атомами.
Электронные оболочки атомов щелочных металлов

Щелочные металлы – это химические элементы первой группы периодической таблицы Менделеева. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов один электрон во внешней электронной оболочке, обозначаемой символом s. Это делает их крайне активными химическими элементами, поскольку они стремятся избавиться от этого электрона и образовать положительный ион.
Атомный номер щелочных металлов определяет количество электронов в оболочках. Например, литий имеет атомный номер 3, что означает, что у него три электрона. Два из них находятся в первой оболочке, а оставшийся один электрон – во внешней оболочке s. Аналогично, у натрия вторая оболочка вмещает восемь электронов, и он имеет один электрон на первой оболочке и один электрон на внешней оболочке s. Такая же ситуация у всех щелочных металлов.
У щелочных металлов внешняя электронная оболочка состоит из одного одиночного электрона, что делает их электронную формулу очень простой. Например, для лития обозначается как 2s1, а для натрия – 2s12p63s1. Это означает, что внешний электрон находится на s-орбитали, а числа после них обозначают количество электронов, занимающих другие орбитали внешней оболочки.
Понятие оболочек и подоболочек

Оболочки и подоболочки - это основные компоненты, определяющие строение атомов щелочных металлов. Оболочки представляют собой электронные облака, в которых находятся электроны атома.
Каждая оболочка обладает энергетическим уровнем, который определяет возможность нахождения электрона в данной оболочке. Энергетические уровни оболочек обозначаются числами и буквами, например, 1s, 2p, 3d и т.д.
Оболочки и подоболочки имеют свойства, которые влияют на химические свойства и реакционную способность атомов щелочных металлов.
Подоболочки - это области внутри оболочек, в которых могут находиться электроны. Они представляют собой энергетические подуровни и обозначаются буквами. Например, в оболочке 2 есть подоболочки 2s и 2p. Каждая подоболочка может содержать определенное количество электронов.
Количество электронов в подоболочке зависит от ее типа, например, подоболочка 2s может содержать не более 2 электронов, а подоболочка 2p - не более 6 электронов.
Структура оболочек и подоболочек атомов щелочных металлов позволяет легко определить их химические свойства и способность к образованию соединений.
Вопрос-ответ

Какую электронную формулу имеют атомы щелочных металлов?
Атомы щелочных металлов имеют общую электронную формулу ns^1.
Что означает общая электронная формула ns^1?
Это означает, что в валентной оболочке атомов щелочных металлов находится один электрон s-орбитали.
Какая особенность электронной структуры атомов щелочных металлов?
Особенностью электронной структуры атомов щелочных металлов является наличие одного электрона в валентной оболочке, что делает их очень реакционноспособными.
Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
