Галогены - это химическая группа элементов, включающая в себя фтор, хлор, бром и йод. Взаимодействие галогенов с металлами является одним из наиболее изученных аспектов химии. Галогены проявляют высокую реакционность при взаимодействии с металлами, что обуславливает широкое применение их соединений в различных областях жизни.
При взаимодействии галогенов с металлами образуются соли - химические соединения, состоящие из металла и аниона галогена. Образование солей происходит благодаря процессу ионизации, в результате которого металлический элемент отдает электроны галогену. Это приводит к образованию положительного иона металла и отрицательного иона галогена, которые с помощью электростатического взаимодействия образуют кристаллическую решетку соли.
Соли, образованные при взаимодействии галогенов с металлами, обладают рядом важных свойств. Они обычно обладают высокой температурой плавления и кипения, что обуславливает их широкое использование в качестве катализаторов и реагентов в химической промышленности. Кроме того, соли галогенов являются хорошими проводниками электричества и химически стабильными соединениями, что позволяет использовать их в электронике и электрохимии.
Галогены и металлы: взаимодействие и образование солей

Галогены, включающие фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At), обладают высокой реакционной способностью, особенно при взаимодействии с металлами. Образование солей является одним из основных процессов в этой реакции.
Когда галоген взаимодействует с металлом, происходит процесс окисления-восстановления, в результате которого образуются ионные соединения, называемые солями. Галогены имеют способность отдавать электроны, при этом металл принимает электроны и становится положительно заряженным ионом. Таким образом, металл и галоген формируют ионы в соли.
Образование солей галогенов и металлов играет важную роль во многих областях. Соли галогенов и щелочных металлов, например, имеют широкое применение в химической промышленности, в производстве тротуарной плитки, стекла, керамики и других материалов.
При взаимодействии различных галогенов с металлами, образуется разнообразие солей. Например, йодиды металлов обладают наибольшей растворимостью, а фториды - наименьшей. Это связано с размерами атомов и ионов галогенов, которые влияют на их взаимодействие с металлом.
Галогены: определение, свойства и состав

Галогены – это группа химических элементов, включающих фтор (F), хлор (Cl), бром (Br) и йод (I). Они относятся к группе 17 (VIIA) периодической системы элементов и известны своими характерными свойствами и реактивностью.
Фтор – самый электроотрицательный элемент в периодической системе элементов. Он обладает высокой реактивностью и может образовывать соли с большинством металлов. Фтор встречается в природе в виде фторида кальция и фторида натрия.
Хлор – ярко-зеленый газовый элемент, который уже при комнатной температуре обладает высокой реактивностью. В природе хлор встречается главным образом в виде хлорида натрия.
Бром – коричневая жидкость с ярким запахом. Он обладает высокой реактивностью и может образовывать соли с многими металлами. Бром был первым элементом из группы галогенов, полученным в элементарной форме.
Йод – темно-синий кристаллический элемент. Он обладает низкой реактивностью по сравнению с другими галогенами и может образовывать соли с некоторыми металлами. Йод встречается в виде йодида натрия в природе.
Галогены обладают высокой электроотрицательностью и часто выступают в реакциях окисления-восстановления. Они также хорошо реагируют с металлами, образуя соли. Галогены широко используются в различных промышленных и научных областях, включая производство пластмасс, протравку металлов и водоочистку.
Металлы: особенности и их реакция с галогенами

Металлы - это элементы химической системы, обладающие специфическими особенностями, такими как высокая электроводность, металлический блеск и способность образовывать ионы положительного заряда.
Металлы реагируют с галогенами, такими как фтор (F), хлор (Cl), бром (Br) и йод (I), образуя различные соли. Реакция металлов с галогенами является экзотермической и сопровождается выделением тепла и света.
При взаимодействии металлов с галогенами образуется ионный кристаллический решетчатый соединений, состоящий из положительных ионов металла и отрицательных ионов галогена. Заряд металлического иона зависит от его группы в периодической системе элементов.
Например, реакция натрия (Na) с хлором (Cl) приводит к образованию кристаллической соли - хлорида натрия (NaCl). Это один из наиболее распространенных примеров взаимодействия металла с галогеном. При этом происходит передача электронов от металлического иона к галогену, что позволяет обоим элементам достигнуть электронной конфигурации, соответствующей газообразному состоянию.
Реакция металлов с галогенами может протекать с различной интенсивностью в зависимости от реактивности каждого элемента. Например, натрий и калий реагируют с галогенами с высокой интенсивностью, при этом происходит интенсивное выделение тепла и света. В то же время, реакция металлов с галогенами в третьей группе периодической системы элементов (например, алюминия и галогенов) проходит менее активно.
Формирование солей: механизм взаимодействия галогенов с металлами

Формирование солей - процесс взаимодействия металлов с галогенами, при котором происходит образование ионных соединений – солей. Этот процесс особенно интенсивен при взаимодействии галогенов с активными металлами вида щелочных металлов.
Механизм взаимодействия галогенов с металлами заключается в передаче электронов от металла к галогену, что приводит к образованию ионов обоих компонентов. Атом металла отдает электрон, становится положительно заряженным ионом, а атом галогена принимает электрон, становится отрицательно заряженным ионом. Образовавшиеся ионы объединяются в кристаллическую решетку, составляющую соль.
Взаимодействие галогенов с металлами происходит с выделением большого количества энергии, что сопровождается выделением тепла и света. Это объясняет яркое полихромное горение галогенов в присутствии активных металлов.
Образование солей на основе галогенов и металлов имеет широкое практическое применение. Например, содержащие йод соли используются в медицине для профилактики и лечения йододефицитных заболеваний. Хлориды и бромиды металлов применяются в процессах химического синтеза, при изготовлении препаратов и в других отраслях промышленности.
Хлориды: образование и свойства

Хлориды – это соединения хлора с металлами, в которых хлор является отрицательным ионом. Образование хлоридов происходит путем обменной реакции между хлором и металлом.
Свойства хлоридов зависят от характера металла, с которым они образуются. Хлориды обладают высокой степенью солевой растворимости, что делает их хорошими электролитами. Большинство хлоридов образуют бесцветные кристаллы, но некоторые из них, например хлорид меди (II), окрашены в синий цвет.
Хлориды имеют высокую температуру плавления и кипения. Например, хлорид натрия плавится при температуре около 800 градусов Цельсия, а кипит при 1413 градусах Цельсия. Некоторые хлориды обладают гигроскопичными свойствами, то есть способностью поглощать воду из окружающей среды.
Хлориды широко применяются в различных областях, включая производство пищевых добавок, фармацевтическую и химическую промышленность, а также в медицине. Например, хлорид натрия используется в качестве основного компонента растворов для внутривенного введения, а хлорид магния – для лабораторных исследований и в качестве добавки в пищу.
Бромиды: процесс образования и использование

Бромиды - это соли бромоводородной кислоты, состоящие из катиона металла и аниона брома. Образование бромидов происходит при реакции галогена (в данном случае брома) с металлом. Для этого необходимо, чтобы окислительная способность брома превышала способность кислорода к окислению металла. Образование бромидов происходит путем передачи электронов от металла к брому, что приводит к образованию ионов металла и бромида.
Бромиды широко используются в различных областях. В медицине бромиды применяются в качестве успокоительных и антиконвульсантных препаратов. Они также используются в фотографии при процессе бромирования. Бромиды натрия и калия применяются в медицине для лечения склеродермии и других заболеваний, связанных с повышенной напряженностью мышц. Кроме того, бромиды применяются в процессе производства некоторых термоустойчивых стекол и керамики.
Бромиды часто используются в аналитической химии, так как они образуют характерные цветные отложения с определенными реагентами. Например, агрегатное состояние раствора щелочных бромидов при добавлении хлорида серебра позволяет определить наличие бромидных иодидных и хлоридных ионов. Бромиды также используются в электролитах для аккумуляторов, а также в качестве реагентов в органическом синтезе.
Фториды: важные свойства и применение

Фториды являются соединениями фтора с другими элементами и обладают рядом важных свойств. Одним из основных свойств фторидов является высокая электроотрицательность фтора, что делает их наиболее реакционноспособными из всех галогенов. Фториды образуются в реакциях фтора с различными металлами, образуя ионный тип связи.
Фториды широко используются в различных областях, например, в производстве стекла и эмалей, в производстве керамики и глазури. Они также находят применение в производстве алюминия и фторирования металлов. Кроме того, фториды используются в качестве катализаторов и реагентов в органическом синтезе. Некоторые фториды, такие как натрий и калий фториды, также используются в качестве пищевых добавок и водоочистителей.
Структура фторидных соединений может быть разнообразной. Например, фториды металлов образуют кристаллические структуры, такие как кубическая, тетрагональная или гексагональная. Фториды неметаллов могут образовывать ковалентные соединения с простой или сложной структурой, обладающие высокими теплоемкостью и плотностью.
- Фториды обладают высокой растворимостью в воде и являются хорошими ионными проводниками.
- Фториды обладают высокой термической и химической стабильностью и не разлагаются при нагревании до высоких температур.
- Фториды обладают высокой токсичностью и коррозионной активностью, поэтому требуется соблюдать осторожность при работе с ними.
В целом, фториды имеют широкий спектр применения и играют важную роль в различных отраслях промышленности и науки.
Иодиды: реакционная способность и химические свойства

Иодиды – соли, в состав которых входит иод. Они представляют собой соединения иода с металлами и относятся к классу галогенидов. Иодиды обладают сильной реакционной способностью и образуют широкий спектр химических соединений, имеющих различные свойства.
Иодиды металлов являются хорошими источниками иона иода в реакциях. Они легко реагируют с оксидами, образуя соответствующие соли и газообразный иод. Это особенно заметно при реакциях с оксидами неактивных металлов, например, с оксидом свинца формируется иодид свинца.
Иодиды также проявляют активность в реакциях с другими галогенами. Например, реакция иодида натрия с бромом приводит к образованию иодида брома. При этом иод вытесняет бром из его соединений и образует иодид. Реакция происходит с выделением энергии.
Иодиды металлов обладают также свойством растворяться в воде и других растворителях, что позволяет использовать их в различных химических процессах. Это делает их важными компонентами в производстве различных химических веществ.
Некоторые иодиды металлов могут обладать искрящимся свойством, например, иодид натрия – существенный компонент в реакциях, используемых для создания фейерверков и пиротехнических изделий. Благодаря своему особым химическим свойствам, иодиды находят применение в качестве катализаторов, а также в медицине и фотографии.
Сравнение солей различных галогенов с металлами: преимущества и недостатки
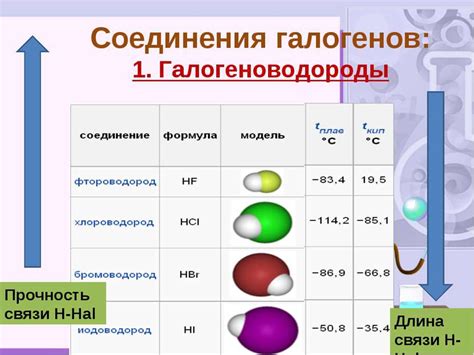
Галогены - это химические элементы, включающие фтор (F), хлор (Cl), бром (Br) и йод (I). Когда они реагируют с металлами, образуются галогениды - соли галогенов. Сравнение различных солей галогенов с металлами позволяет выявить их преимущества и недостатки в различных условиях.
Преимуществом солей флюорида является их высокая растворимость в воде, что делает их легко доступными для использования. Фторидный ион также обладает малым размером, что улучшает его взаимодействие с металлами и способствует образованию стабильных соединений. Однако, недостатком солей флюорида является их высокая токсичность и ограниченное применение в некоторых отраслях промышленности.
Соли хлорида широко используются в промышленности и пищевой отрасли. Они хорошо растворимы в воде и образуют стабильные соединения с металлами. Однако, хлоридные ионы могут вызывать коррозию металлов и ограничивать их применение в некоторых областях, таких как электроника.
Бромидные ионы образуют менее стабильные соединения с металлами, поэтому соли брома обычно менее стабильны и менее растворимы в воде. Однако, они находят применение в фотографии, медицине и жидких охладителях. Бромиды также не оказывают сильного влияния на коррозию металлов.
Соли йода обычно образуют менее стабильные соединения с металлами и имеют низкую растворимость. Однако, они имеют применение в медицине и пищевой отрасли, благодаря своим антимикробным свойствам. Йодиды также могут вызывать коррозию металлических поверхностей, поэтому их применение ограничено в некоторых случаях.
В целом, выбор между различными солями галогенов зависит от требуемых свойств соединения и сферы его применения. Каждый галоген имеет свои преимущества и недостатки, которые необходимо учитывать при выборе соли для конкретного применения.
Вопрос-ответ

Какие галогены могут взаимодействовать с металлами?
С металлами могут взаимодействовать галогены такие, как хлор (Cl), бром (Br), иод (I) и фтор (F).
Что такое соль?
Соль - это химическое соединение, которое образуется в результате реакции взаимодействия металлов с галогенами. Соль состоит из ионов металла и ионов галогена.
