Взаимодействие галогенов с металлами представляет собой важный и интересный процесс, в результате которого образуются различные соединения. Галогены - это элементы группы VII периодической системы, включающие фтор (F), хлор (Cl), бром (Br) и йод (I). Металлы, в свою очередь, характеризуются высокой электропроводностью и химической реактивностью.
Взаимодействие галогенов с металлами приводит к образованию галогенидов - химических соединений, которые обладают различными свойствами и применяются в разных отраслях науки и промышленности. Галогениды могут иметь различные структуры и формы, в том числе кристаллические или аморфные состояния.
Процесс образования галогенидов металлов обычно осуществляется путем химической реакции между металлом и галогеном. Реакция может быть самостоятельной или требовать наличие катализаторов или дополнительных реагентов. Результатом такой реакции может быть образование галогенидов различной степени окисления и состава.
Взаимодействие галогенов с металлами

Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br) и иод (I). Они имеют высокую электроотрицательность и исторически привлекали внимание ученых своим взаимодействием с металлами.
При контакте галогенов с металлами, происходит образование галогенидов металлов. Галогениды металлов представляют собой ионные соединения, где галоген выступает в качестве отрицательного иона, а металл - в качестве положительного иона.
Взаимодействие галогенов с металлами может происходить при нагревании, при наличии растворителя или при воздействии электрического тока. Например, реакция хлора с железом приводит к образованию хлорида железа:
- 2Fe + 3Cl2 → 2FeCl3
Взаимодействие галогенов с металлами может быть использовано для синтеза различных соединений. Например, обработка металлической фольги бромом может привести к образованию бромида металла. Также такие реакции могут использоваться для анализа содержания металлов в различных образцах.
Важно отметить, что галогены имеют высокую реакционную активность и могут вызывать коррозию металлов. Поэтому при работе с галогенами необходимо соблюдать меры безопасности и использовать защитные средства.
Галогены и их свойства

Галогены - это химические элементы 17-ой группы периодической системы. Они включают в себя фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Эти элементы обладают рядом уникальных свойств, которые делают их важными во многих химических и промышленных процессах.
Одной из основных характеристик галогенов является их высокая реакционная способность. Они образуют стойкие соединения с другими элементами, включая металлы. Например, галогены могут образовывать соли с металлами путем замещения их органических соединений. Это свойство нашло широкое применение в химической промышленности и производстве различных продуктов.
Галогены также известны своей высокой электроотрицательностью, то есть способностью притягивать электроны. Их атомы обладают семью электронами во внешней оболочке, что делает их активными в процессах окисления и восстановления. Галогены проявляются как кислоты, образуя оксокислоты с кислородом и галогениды с металлами.
Также галогены обладают разными физическими свойствами: фтор и хлор - газы при нормальных условиях, бром - жидкость, йод - твердое вещество с высокой точкой плавления. Они обладают отличными световыми иллюминирующими свойствами, их соединения широко используются в промышленности светотехники и различных электронных приборов.
Образование соединений галогенов с металлами
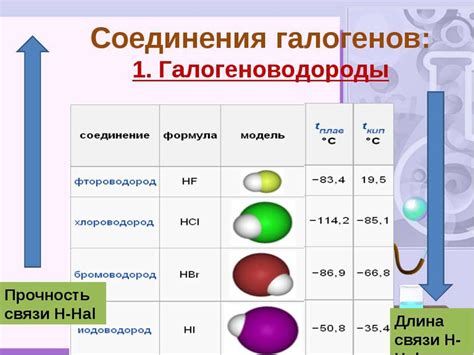
Галогены – это элементы группы 17 или 7 периодической таблицы, которые включают в себя фтор (F), хлор (Cl), бром (Br) и йод (I). Эти элементы имеют высокую электроотрицательность и проявляют активность в химических реакциях.
Галогены могут образовывать соединения с различными металлами, в результате чего образуются галогениды. Образование таких соединений осуществляется путем переноса электронов от металла к галогену, что приводит к образованию ионов галогенидов.
Соединения галогенов с металлами обладают высокой химической и физической активностью. Они часто используются в различных сферах, таких как фармацевтика, производство пластиков и металлов, электроника и др.
Примерами таких соединений являются хлорид натрия (NaCl), бромид калия (KBr), йодид кальция (CaI2). Эти соединения обладают различными свойствами и имеют широкий спектр применений.
Образование соединений галогенов с металлами является важным процессом в химии и имеет большое значение в различных технологических процессах. Познание этих соединений и их свойств позволяет разрабатывать новые материалы и технологии, что способствует развитию науки и промышленности.
Свойства соединений галогенов с металлами

Соединения галогенов с металлами обладают рядом уникальных свойств, которые определяют их широкое применение в различных областях науки и промышленности.
- Низкая температура плавления и кипения. Большинство соединений галогенов с металлами обладают низкой температурой плавления и кипения, что делает их удобными для использования в процессах низкотемпературной синтеза и смешения с другими веществами.
- Химическая активность. Галогены являются сильными окислителями, поэтому соединения галогенов с металлами обладают высокой химической активностью. Они способны проявляться в реакциях с различными веществами, образуя новые соединения и проявляя свои особенности.
- Фотолюминесценция. Некоторые соединения галогенов с металлами обладают свойством фотолюминесценции, то есть способностью излучать свет при воздействии электромагнитного излучения. Это свойство открывает широкие возможности для применения данных соединений в различных технологиях светодиодов, лазеров и оптических устройств.
- Устойчивость к экстремальным условиям. Соединения галогенов с металлами обладают высокой устойчивостью к экстремальным условиям, таким как высокая температура, давление и агрессивные среды. Это позволяет использовать данные соединения в процессах, требующих высокой стойкости и стабильности.
В результате, соединения галогенов с металлами являются важными составляющими в различных сферах науки и техники, от электроники и оптики до медицины и энергетики. Изучение и применение данных соединений способствует развитию новых технологий и материалов с уникальными свойствами.
Вопрос-ответ

Какое взаимодействие происходит между галогенами и металлами?
Взаимодействие галогенов с металлами происходит путем образования соединений. Галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), могут образовывать стабильные соединения с металлами путем передачи электронов. Это вызывает изменение химических свойств металла и формирование химической связи между галогеном и металлом.
Какие соединения могут образовываться между галогенами и металлами?
Между галогенами и металлами могут образовываться различные соединения, такие как металлические галогениды и галогенные анионы. Например, образование металлических галогенидов, таких как фториды, хлориды, бромиды и йодиды, являются частым результатом взаимодействия металлов с соответствующими галогенами.
Какие свойства могут получить галогениды металлов?
Галогениды металлов обладают рядом свойств, которые зависят от конкретного металла и галогена. Некоторые общие свойства галогенидов металлов включают высокую температуру плавления и кипения, низкую летучесть, хорошую растворимость в воде и других распространенных растворителях, электропроводность, высокую токсичность, а также способность образовывать кристаллические структуры.
Возможно ли обратное взаимодействие, т.е. образование галогенидов из металлов?
Обратное взаимодействие, т.е. образование галогенидов из металлов, технически возможно, но составление стабильных галогенидов металлов является более распространенным процессом. Обратное взаимодействие может происходить в присутствии соответствующих условий, таких как высокая температура или использование химических реагентов, способных вытеснить галоген из соединения металла.
