Взаимодействие щелочного металла с серой является одним из важных химических процессов, которые приводят к образованию различных соединений. Щелочные металлы, такие как натрий, калий и литий, имеют способность соединяться с серой, образуя стабильные химические соединения.
При взаимодействии щелочного металла с серой образуется соединение сульфида щелочного металла. Сульфиды щелочных металлов обладают характерным запахом и цветом. Кроме того, они являются хорошими проводниками электричества и обладают высокой теплопроводностью.
Сульфиды щелочных металлов имеют широкое применение в различных областях. Например, сульфид натрия (Na2S) используется в производстве бумаги, текстиля и кожи. Сульфид калия (K2S) применяется в производстве удобрений, стекла и керамики. Сульфид лития (Li2S) используется в производстве литий-ионных аккумуляторов и фармацевтических препаратов.
Взаимодействие щелочного металла с серой является сложным химическим процессом, который может быть использован для синтеза различных полезных соединений с уникальными свойствами.
Взаимодействие щелочных металлов с серой
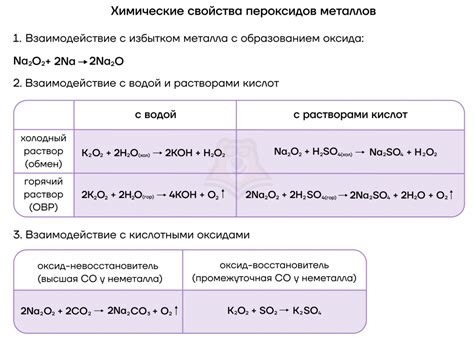
Щелочные металлы - это элементы, которые находятся в первой группе таблицы Менделеева, включая литий, натрий, калий, рубидий и цезий. Они отличаются высокой активностью и реактивностью, особенно при контакте с веществами, содержащими серу. Взаимодействие щелочных металлов с серой приводит к образованию различных соединений.
Сера - это химический элемент с атомным номером 16. Она имеет возможность образовывать разнообразные соединения с другими элементами, включая щелочные металлы. В результате взаимодействия щелочных металлов с серой могут образовываться сульфиды, сульфиты и другие серосодержащие соединения.
Например, взаимодействие натрия с серой приводит к образованию натриевого сульфида (Na2S), который является одним из наиболее распространенных сульфидов щелочных металлов. Этот сульфид обладает неприятным запахом и может реагировать с водой, образуя сероводород (H2S).
Также щелочные металлы могут образовывать сульфиты, например, натриевый сульфит (Na2SO3). Сульфиты широко используются в пищевой промышленности как консерванты, а также в производстве бумаги и других отраслях.
В целом, взаимодействие щелочных металлов с серой является важным аспектом в химии и может приводить к образованию различных соединений с разнообразными свойствами и применениями.
Общая информация о взаимодействии щелочных металлов с серой

Щелочные металлы – это элементы первой группы периодической системы, которые взаимодействуют с серой, образуя соединения. Среди щелочных металлов можно выделить литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Взаимодействие щелочных металлов с серой приводит к образованию различных соединений, таких как сульфиды и полисульфиды. Серный атом может образовать несколько связей с атомами щелочного металла, что позволяет образовывать различные структуры и комплексы.
Образование соединений при взаимодействии щелочного металла с серой происходит за счет реакции между ионами металла и атомами серы. Например, в результате реакции натрия с серой образуется натрийсерный (Na2S) – одно из наиболее распространенных соединений щелочных металлов с серой.
Соединения щелочных металлов с серой обладают различными свойствами и находят применение в различных отраслях промышленности, таких как производство стекла, аккумуляторы, фотоэлементы и другие. Изучение взаимодействия щелочных металлов с серой имеет важное значение для развития материаловедения и новых технологий.
Соединения, образующиеся при взаимодействии щелочных металлов с серой

Щелочные металлы (например, натрий, калий, рубидий, цезий) обладают высокой реакционной способностью и легко взаимодействуют с серой, образуя различные соединения.
Одним из основных соединений, получаемых при взаимодействии щелочных металлов с серой, является сульфид щелочного металла. Этот сульфид имеет химическую формулу MS, где M обозначает щелочный металл. Сульфиды щелочных металлов обладают высокой температурной стабильностью и широким спектром применения.
В результате взаимодействия щелочных металлов с серой могут образовываться и другие соединения. Например, полисульфиды щелочных металлов – это соединения, в которых сера содержится в форме S_n^2-, где n может быть разным числом. Полисульфиды щелочных металлов могут быть использованы в производстве различных химических соединений, в том числе и в качестве последовательных анодных материалов для литий-серных аккумуляторов.
Также при взаимодействии щелочных металлов с серой может образовываться сульфат щелочного металла. В этом случае сера соединяется с щелочным металлом в оксидной форме. Сульфаты щелочных металлов широко применяются в различных отраслях промышленности, в том числе в производстве стекла, керамики и удобрений.
Таким образом, взаимодействие щелочных металлов с серой приводит к образованию различных соединений, таких как сульфиды, полисульфиды и сульфаты щелочных металлов. Эти соединения имеют широкий спектр применения в различных отраслях науки и промышленности.
Свойства соединений щелочных металлов и серы

Соединения щелочных металлов и серы представляют собой важную группу соединений, которые обладают рядом уникальных свойств.
Одним из наиболее известных соединений щелочных металлов и серы является серный ангидрид, или диоксид серы (SO2). Это безцветный газ с резким запахом, который образуется при сгорании или окислении серы. Серный ангидрид обладает высокой токсичностью и может вызывать раздражение дыхательных путей.
Щелочные металлы также могут образовывать соединения с серой, которые имеют вид солей - сульфатов. Например, натрий образует натрий сульфат (Na2SO4), который является безцветной кристаллической солью, используемой в различных отраслях промышленности.
Соединения щелочных металлов и серы обладают уникальными электрохимическими свойствами. Они могут служить важными компонентами в процессе электролиза и использоваться для получения металлов в чистом виде. Например, калий сульфат (K2SO4) используется для производства калия методом электролиза.
Кроме того, соединения щелочных металлов и серы имеют широкий спектр применений в различных областях, таких как химическая промышленность, фармацевтика и сельское хозяйство.
Применение соединений щелочных металлов и серы в индустрии

Соединения щелочных металлов и серы широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам и химическим реакциям. Они находят применение в производстве прямоугольных сечений, энергетике, химической промышленности и других областях.
В производстве прямоугольных сечений соединения щелочных металлов и серы используются для создания жаростойкого сплава. Этот сплав обладает высокой прочностью и стойкостью к коррозии, что делает его идеальным материалом для изготовления рам окон, дверей и других конструкций.
В энергетике соединения щелочных металлов и серы используются в процессе получения водорода. В этом случае, щелочной металл взаимодействует с серой, образуя соединение, которое затем превращается в водород. Водород, получаемый таким образом, является чистым и безопасным и может быть использован в различных целях, включая производство электрической энергии.
В химической промышленности соединения щелочных металлов и серы применяются в качестве катализаторов для различных химических процессов. Они способны ускорять скорость реакций, увеличивать выборку продуктов и улучшать качество конечной продукции. Катализаторы на основе соединений щелочных металлов и серы могут использоваться в производстве полимеров, удобрений и других химических веществ.
Также соединения щелочных металлов и серы применяются в производстве резиновых товаров и полимерных материалов. Они используются в качестве компонента для обеспечения высокой эластичности и прочности изделий. Благодаря соединениям щелочных металлов и серы, резиновые товары становятся устойчивыми к истиранию и воздействию внешних факторов, таких как высокая температура или химические реагенты.
Итак, применение соединений щелочных металлов и серы в индустрии находит все большее распространение, благодаря их уникальным свойствам и возможностям. Они обеспечивают прочность, жаростойкость, ускоряют химические реакции и придают особые характеристики различным материалам и веществам.
Вопрос-ответ

Какие соединения могут образовываться при взаимодействии щелочного металла с серой?
При взаимодействии щелочного металла с серой могут образовываться различные соединения, такие как сульфиды и полисульфиды. В зависимости от условий реакции и соотношения реагентов, образование определенного соединения может быть более или менее вероятным. Например, при нагревании металла со серой в присутствии избытка серы, может образоваться полисульфид металла.
Чем отличаются сульфиды и полисульфиды, образующиеся при взаимодействии щелочного металла с серой?
Сульфиды и полисульфиды, образующиеся при взаимодействии щелочного металла с серой, различаются по количеству атомов серы в молекуле. Сульфиды содержат один атом серы в молекуле, например, Na2S. При взаимодействии металла с серой в присутствии избытка серы, могут образовываться полисульфиды, содержащие больше одного атома серы в молекуле, например, Na2Sx (где x может быть равным 2, 3 и т.д.). Полисульфиды обычно обладают более сложной структурой и свойствами, чем сульфиды.
Какие свойства имеют сульфиды и полисульфиды, образующиеся при взаимодействии щелочного металла с серой?
Сульфиды и полисульфиды, образующиеся при взаимодействии щелочного металла с серой, обладают различными свойствами. Сульфиды обычно являются твердыми веществами, не растворимыми в воде. Они могут образовывать кристаллические структуры и обладать определенными электрическими и термическими свойствами. Полисульфиды обычно являются нестабильными соединениями, которые могут деградировать при воздействии влаги и воздуха. Они могут использоваться в различных химических процессах, таких как селективная окислительная дезинфекция воды.
