Реакция металлов с кислородом – процесс, который ведет к образованию соединений, называемых оксидами. Эти соединения возникают в результате химической реакции между металлом и молекулами кислорода. Оксиды металлов являются широко распространенными соединениями и играют важную роль в химии и технологии.
Во время реакции с кислородом металлы обычно окисляются, то есть теряют электроны, а кислород восстанавливается и принимает эти электроны. В результате этой реакции образуется оксид металла. Конкретный вид оксида зависит от металла, который участвует в реакции. Некоторые оксиды металлов являются ионными соединениями, в которых катионы металла соединены с анионами кислорода. Другие оксиды, такие как пероксиды и супероксиды, содержат кислородные группы с более высокой степенью окисления.
Изменение доли окисления металла при образовании оксида определяется электрохимическими свойствами металла, его электронной структурой и взаимодействием с кислородом. Способность металла образовывать оксиды может быть связана с его электрохимической активностью и позицией в ряду напряжений. Некоторые металлы, такие как натрий и калий, очень активны и мгновенно реагируют с кислородом в атмосфере. Другие металлы, такие как золото и платина, не реагируют с кислородом при нормальных условиях.
Оксид металла и его свойства

Оксид металла - это химическое соединение, образующееся при реакции металла с кислородом. Оксиды металлов широко распространены в природе и играют важную роль как в живой, так и в неживой природе.
Оксиды металлов обладают разнообразными химическими и физическими свойствами. В большинстве своем они являются твердыми веществами, но существуют и жидкие и газообразные оксиды. Например, оксид алюминия (Al2O3) - это твердое, непрозрачное и кристаллическое вещество, тогда как оксид азота (NO) - это газовый оксид.
Оксиды металлов обладают различными цветами. Например, оксид железа (Fe2O3) имеет красный цвет, оксид меди (CuO) - черный, а оксид алюминия (Al2O3) - белый. Это свойство оксидов металлов определяется структурой и электронными свойствами атомов металла и кислорода.
Оксиды металлов обычно обладают высокой теплопроводностью и электропроводностью. Это свойство связано с наличием ионов металла и кислорода в структуре оксида. Например, оксид меди (CuO) является полупроводником и используется в электронике.
Некоторые оксиды металлов обладают кислотными свойствами и растворяются в воде, образуя щелочные растворы. При этом они образуют гидроксиды металлов. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH).
Оксиды металлов широко используются в различных отраслях промышленности и науке. Они служат основой для производства металлов, катализаторов, керамики и стекла, а также применяются в производстве батареек, электродов и других электронных устройств.
Реакция оксида металла с кислородом
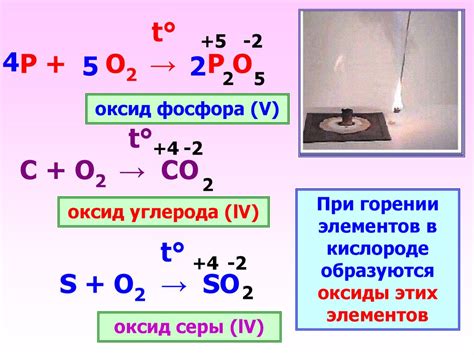
Оксид металла – вещество, образующееся при соединении металла с кислородом. Реакция оксида металла с кислородом происходит при поглощении последним металла и сопровождается выделением тепла.
Процесс образования оксида металла при реакции с кислородом имеет важное значение в химической и металлургической промышленности. В результате таких реакций получаются различные виды оксидов металлов – основных, амфотерных или кислых.
Оксиды металлов характеризуются разными свойствами и применяются в разных отраслях нашей жизни. Например, оксиды металлов используются в производстве стекла, керамики, электроники, медицины и других областях.
Реакция оксида металла с кислородом может протекать с различной интенсивностью в зависимости от условий, таких как температура, давление и концентрация реагентов. Она может быть спонтанной или требовать введения энергии для инициирования процесса.
Реакция оксида металла с кислородом может иметь место и в атмосфере, где кислород является основным окислителем для реакций с металлами. Такие реакции особенно активны в высокотемпературных процессах, например, при горении или воспламенении металлов.
Образование оксида металла при взаимодействии с кислородом
Взаимодействие металлов с кислородом имеет важное значение в химии и технологии. Одним из результатов этого взаимодействия является образование оксида металла. Оксиды металлов широко распространены как в природе, так и в промышленности. Они играют важную роль в различных процессах и имеют множество применений.
Взаимодействие металлов с кислородом происходит при высоких температурах или при наличии катализаторов. При этом металлы окисляются, а кислород вступает в реакцию с ними, образуя оксиды металла. Этот процесс обычно сопровождается выделением энергии в виде тепла и света.
В результате взаимодействия металла с кислородом образуется стабильное соединение - оксид металла. Оксиды металлов обладают различными свойствами и активно применяются в различных отраслях промышленности. Например, оксид железа (Fe2O3) применяется в производстве стали, оксид алюминия (Al2O3) используется в керамике и алюминиевой промышленности, а оксид кальция (CaO) широко применяется в строительстве.
Образование оксидов металлов при взаимодействии с кислородом является одним из ключевых процессов в химической промышленности. Эти вещества имеют важное значение не только в производстве, но и в нашей повседневной жизни. Знание основных свойств оксидов металлов помогает понять их воздействие на окружающую среду и применять их с умом.
Важность образования оксида металла в природе
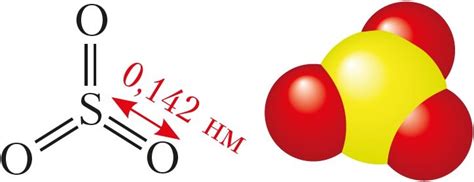
Оксиды металлов являются важным компонентом природных процессов и имеют широкий спектр применений. Образование оксида металла в результате реакции с кислородом имеет большое значение для обеспечения жизнедеятельности многих видов организмов и существования различных экосистем.
В первую очередь, образование оксида металла позволяет металлам сохранять свои физические и химические свойства при взаимодействии с окружающей средой. Оксиды металлов обладают высокой стабильностью и не подвержены разложению водой или другими химическими реагентами. Благодаря этому свойству, оксиды металлов являются прочными и долговечными материалами для строительства и производства различных изделий.
Кроме того, оксиды металлов играют важную роль в биохимических процессах, происходящих в организмах. Например, некоторые оксиды металлов, такие как оксид железа, являются необходимыми компонентами для нормального функционирования организма. Они участвуют в процессах кислородного транспорта и обеспечивают достаточное поступление кислорода к тканям и органам.
Также, образование оксида металла имеет значение для геологических процессов и формирования природных ресурсов. Некоторые оксиды металлов образуются при окислении металлических руд и являются индикаторами их наличия в земле. Это позволяет геологам и исследователям находить месторождения полезных ископаемых, таких как железо, медь или алюминий.
В заключение, образование оксида металла при реакции с кислородом играет важную роль в природе. Оно обеспечивает стабильность и долговечность металлических материалов, участвует в биохимических процессах организмов и способствует нахождению природных ресурсов. Понимание этого процесса позволяет сформировать более глубокое представление о функционировании мира и использовать его в различных областях жизни.
Применение образования оксида металла в промышленности

Образование оксида металла при реакции с кислородом имеет широкое применение в различных отраслях промышленности. Оксиды металлов являются важными компонентами многих материалов и продуктов, которые мы используем в повседневной жизни.
Одним из основных применений оксида металла является производство металлических сплавов. Оксиды металлов, такие как оксид железа, оксид алюминия и оксид меди, могут быть использованы для получения специфических свойств сплавов. Например, добавление оксида железа в сталь повышает ее прочность и устойчивость к коррозии.
Кроме того, оксиды металлов используются в производстве керамики. Например, оксид алюминия, известный как алюминиевая керамика, обладает высокой теплостойкостью и применяется в изготовлении термостойких изделий, таких как горшки для плит и керамические ножи.
Еще одним важным применением образования оксида металла является производство красок и пигментов. Многие оксиды металлов обладают яркими цветами и используются для придания цветных оттенков лакам, краскам, косметическим продуктам и другим материалам.
Также стоит отметить, что оксиды металлов имеют важное значение в электронике и электротехнике. Оксид цинка, например, применяется в производстве полупроводниковых элементов, таких как диоды и транзисторы. Оксид меди используется в производстве печатных плат и солнечных панелей.
В заключение, образование оксида металла при реакции с кислородом играет важную роль в промышленности. Оксиды металлов используются для создания сплавов, керамики, красок и пигментов, а также в электронике и электротехнике. Эти материалы находят широкое применение в различных отраслях и способствуют развитию современной технологии.
Вопрос-ответ

Какие металлы могут образовывать оксиды при реакции с кислородом?
Многие металлы могут образовывать оксиды при реакции с кислородом, включая железо, алюминий, медь, цинк и т. д.
Какова роль кислорода при реакции с металлом?
Кислород является окислителем при реакции с металлом. Он отбирает электроны от металла, что приводит к образованию оксида металла.
Какие свойства имеют оксиды металлов?
Оксиды металлов обычно обладают свойствами ионных или ковалентных соединений. Они могут быть твердыми, безцветными, кристаллическими веществами с высокими температурами плавления и кипения. Некоторые оксиды металлов образуют щелочные растворы, другие - кислотные растворы.
Для чего используются оксиды металлов?
Оксиды металлов имеют широкий спектр применений. Некоторые из них используются в качестве пигментов для красок и керамики, другие - в производстве стекла, электроники или катализаторов. Некоторые оксиды металлов также используются в медицине для лечения различных заболеваний.
