Металлы - это вещества, которые обладают высокой электропроводностью и блестящей поверхностью. Одной из основных особенностей металлов является то, что атомы этих элементов образуют между собой металлическую связь. Это специфическое явление обусловлено особыми свойствами внешней оболочки металлических атомов и их способностью отдавать электроны.
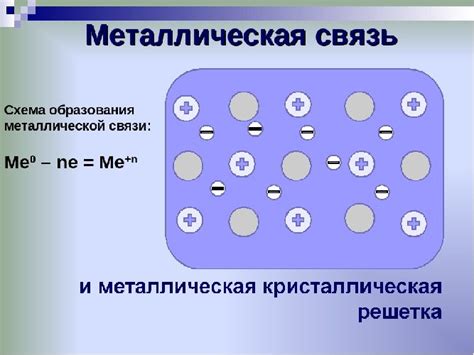
Основной критерий образования металлической связи – это наличие свободных электронов в валентной оболочке атомов металла. Отличие металлов от неметаллов состоит в том, что у металлов эти свободные электроны могут двигаться по всему объему материала, образуя так называемый "электронный мор" или "электронное облако". Это делает металлы хорошими проводниками электричества и тепла.
Металлическая связь обуславливает основные свойства металлов. Именно благодаря свободным электронам атомы металлов образуют кристаллическую решетку, что придает металлам прочность, тугоплавкость и способность к деформации без разрушения. Также металлическая связь отвечает за уникальные физические свойства металлов: высокую теплопроводность, магнитные свойства и блеск.
Металлическая связь: основные понятия

Металлическая связь – это тип химической связи, характерный для металлов. Она образуется между атомами металла и обладает рядом основных характеристик.
Первое основное понятие – деликальность. Атомы металла в металлической связи образуют кристаллическую решетку, которая обладает определенной степенью упорядоченности. Это позволяет атому быть окруженным большим числом других атомов валентного металла, что является одной из причин высокой проводимости электричества и тепла в металлах.
Второе основное понятие – ионность. В металлической связи атомы металла теряют один или несколько электронов из своей валентной оболочки, образуя положительно заряженные ионы, которые окружаются облаком электронов, свободно движущихся по всему металлу. Такая ионность обуславливает высокую электропроводность и теплопроводность металлов.
Третье основное понятие – малая прочность связи. Металлическая связь является относительно слабой по сравнению с ковалентной или ионной связью. Это позволяет атомам металла свободно двигаться в кристаллической решетке и обеспечивает металлам высокую пластичность и формоизменяемость.
Итак, металлическая связь – это особый тип химической связи, который образуется между атомами металла и обладает деликальностью, ионностью и малой прочностью связи. Благодаря этим особенностям металлы обладают высокой электропроводностью, теплопроводностью и пластичностью, что делает их неотъемлемой частью нашей повседневной жизни.
Правда: атомы металлов и металлическая связь

Металлическая связь – это особый тип химической связи, который возникает между атомами металлов. Он обусловлен особенностями внутренней структуры металлических элементов и их способностью образовывать сети кристаллической решетки.
Атомы металлов имеют способность отдавать электроны своей валентной оболочки для образования электронного облака, которое обеспечивает сильные электростатические связи между атомами. Эти электроны, которые называются электронами свободной зоны, образуют общую электронную оболочку для всех атомов в металле.
Металлическая связь характеризуется низкой энергией связи, что обусловлено большим количеством электронов свободной зоны и их подвижностью. Также, благодаря связи между атомами, металлические материалы обладают высокой теплопроводностью и электропроводностью.
Кристаллическая решетка, образованная атомами металлов, может иметь различную структуру: кубическую, гексагональную, квадратную и др. Эта структура определяет многочисленные свойства металлов, такие как механическая прочность, пластичность, тугоплавкость и др.
Таким образом, атомы металлов образуют металлическую связь, которая обусловливает особые свойства и характеристики металлических материалов.
Мифы о металлической связи и атомах металлов
Вокруг металлической связи и атомов металлов существует множество мифов и неправильных представлений. Одним из таких мифов является утверждение о том, что атомы металлов образуют металлическую связь путем обмена электронами. На самом деле, процесс образования металлической связи более сложный и основан на сильном притяжении электронов к положительно заряженным ионам металла.
Другой распространенный миф связан с понятием "свободных электронов" в металлах. Часто считается, что атомы металлов имеют свободных электронов, которые могут свободно перемещаться внутри кристаллической решетки. Однако, на самом деле, электроны в металле не являются полностью свободными, а скорее находятся в высокоорбитальных состояниях, которые предоставляют ряд свободных энергетических уровней для электронов.
Третий миф относится к представлению о том, что связь между атомами металлов является слабой и нестабильной. На самом деле, металлическая связь является очень прочной и устойчивой, что объясняет высокую пластичность и прочность металлов. Связь между атомами металлов основана на электростатическом притяжении положительных ионов атомов и общей "оболочке" свободных электронов.
В итоге, металлическая связь и атомы металлов являются сложными и интересными объектами изучения. Они имеют свои особенности и свойства, которые далеки от распространенных мифов и неправильных представлений.
Научные доказательства: атомы металлов и их связь

Металлическая связь является одной из основных типов химической связи, которая описывает взаимодействие атомов металлов в кристаллической решетке или в металлическом кластере. Научные исследования многие годы подтверждают существование и природу металлической связи.
Атомы металлов обладают особыми свойствами, которые позволяют им образовывать металлическую связь. Во-первых, у металлов имеется большое число свободных электронов в валентной оболочке, которые могут свободно передвигаться по кристаллической решетке. Это создает электронное облако, которое поддерживает структурную целостность металла.
Структура металлической связи основана на понятии металлической решетки, в которой атомы металла занимают определенные позиции и образуют устойчивую структуру. Металлическая связь предполагает, что атомы металла делят свои электроны между собой, что создает электронный газ или свободные электроны. Эти свободные электроны не принадлежат ни одному конкретному атому, а движутся по всему объему металла, формируя электронное облако.
Электронное облако удерживается вместе благодаря притяжению положительно заряженного ядра и отталкиванию электронов между собой. Эти свойства металла, такие как высокая теплопроводность и электропроводность, объясняются именно наличием металлической связи.
Научные исследования позволяют изучить особенности металлической связи более подробно. Так, методы рентгеноструктурного анализа позволяют определить расстояния между атомами в металлической решетке, а методы спектроскопии позволяют изучать энергетическую структуру электронов в металлической связи.
Выводы научных исследований подтверждают, что металлическая связь - не вымысел, а реальное явление, которое объясняет особенности строения и свойства металлов.
Вопрос-ответ

Какие атомы образуют металлическую связь?
Металлическая связь образуется между атомами металлов. Она возникает из-за особенностей строения и взаимодействия электронов в металлической решетке.
Как происходит образование металлической связи?
Образование металлической связи происходит благодаря специфическим свойствам атомов металлов. В металлах нарушается слоистая структура атомов, а внешние электроны становятся подвижными. Это позволяет создать общую электронную оболочку, в которой электроны свободно движутся между атомами, образуя так называемое "море" электронов.
Чем отличается металлическая связь от других видов связей?
Металлическая связь отличается от ионной и ковалентной связи. В ионной связи электроны передаются полностью от одного атома к другому, образуя положительный и отрицательный ионы. В ковалентной связи электроны образуют общие пары, которые существуют между двумя атомами. В металлической связи электроны образуют общую оболочку между множеством атомов, образуя своего рода "море" электронов, которое обеспечивает веществу металлы его характерные свойства.
