Атомы металлов и неметаллов имеют различные свойства, основанные на их электронной структуре. Металлы обладают низкой электроотрицательностью, что означает, что они имеют способность отдавать электроны, образуя положительно заряженные ионы.
При образовании ионной связи между атомами металлов и неметаллов, металлы обычно отдают электроны и становятся положительно заряженными ионами. Это связано с тем, что у металлов на внешнем электронном уровне находятся всего один или несколько электронов, что делает их достаточно легкими для отдачи.
Металлы, отдавая электроны, образуют положительно заряженные ионы, которые притягиваются к отрицательно заряженным ионам неметаллов. Эта притяжение образует ионную связь, которая характеризуется прочностью и устойчивостью, что делает металлы и ионы металлов источником стабильности в химических соединениях.
Следует отметить, что при образовании ионной связи ионы металлов могут принимать электроны, особенно в случаях, когда они имеют большую электроотрицательность по сравнению с некоторыми неметаллами. Однако, в общем случае ионы металлов склонны отдавать электроны, чтобы образовать стабильные химические соединения.
Роль атомов металлов в ионной связи
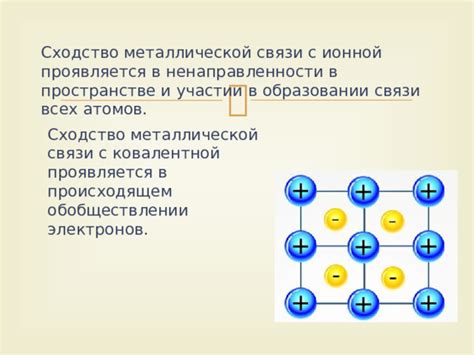
Атомы металлов играют важную роль при образовании ионной связи, представляя собой источник электронов или принимая их от других атомов. В ионной связи происходит трансфер электронов, что позволяет образованию ионов и образованию кристаллической решетки.
Металлические атомы обладают низкой электроотрицательностью и слабо притягивают электроны, поэтому в процессе ионного связывания они предпочитают отдавать свои электроны, становясь положительно заряженными ионами (катионами).
Процесс отдачи электронов приводит к тому, что валентная оболочка металлического атома остается с положительным зарядом, который может быть скомпенсирован зарядом других атомов. В результате такого обмена зарядами образуются истинные ионы, позволяющие формированию устойчивой ионной связи.
Созданные ионы металлов с положительным зарядом притягивают анионы, образуя кристаллическую решетку, где положительные ионы занимают позиции в решеточных узлах, а отрицательные ионы окружают их, образуя электростатические связи.
Таким образом, роль атомов металлов в ионной связи заключается в отдаче электронов и образовании положительно заряженных ионов, что позволяет формированию кристаллической решетки и устойчивой структуры.
Процесс образования ионной связи
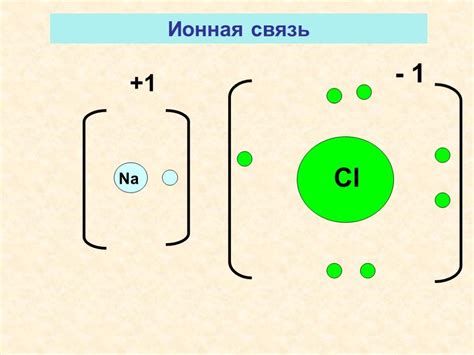
Ионная связь – это тип химической связи, который происходит между атомами металлов и атомами неметаллов, в результате которого образуются положительно и отрицательно заряженные ионы. Образование ионной связи осуществляется путем передачи или приема электронов атомами металла и атомами неметалла.
Атомы металлов обладают малой электроотрицательностью и большим радиусом, что позволяет им легко отдать электроны и образовать положительно заряженные ионы – катионы. Атомы неметаллов, напротив, обладают большей электроотрицательностью и меньшим радиусом, что способствует их способности принимать электроны и образовывать отрицательно заряженные ионы – анионы.
В процессе образования ионной связи, атом металла отдает один или более электронов атому неметалла, чтобы достичь стабильной октетной конфигурации электронов во внешнем электронном слое. В результате антипараллельного движения электронов, формируются электростатические силы притяжения между положительно заряженными катионами и отрицательно заряженными анионами, образуя ионную связь.
Получившиеся ионы в ионной связи притягиваются друг к другу сильными электростатическими силами, что делает образующееся соединение ионным кристаллическим решеткой с определенной структурой. Образование ионной связи характеризуется высокой температурой плавления и кипения соединений, а также отсутствием электрической проводимости в твердом состоянии, но наличием проводимости в расплавленном или растворенном состоянии.
Передача или отдача электронов?

Атомы металлов при образовании ионной связи могут либо отдать, либо передать электроны. Этот процесс зависит от того, какой элемент взаимодействует с металлом.
В ионной связи атомы металла, такие как натрий, кальций или магний, отдают электроны внешних энергетических орбиталей. Эти атомы обладают относительно малым количеством электронов в внешней оболочке и имеют тенденцию стать положительно заряженными ионами или катионами. Передача электронов от атомов металла к другим атомам этой связи позволяет образовать стабильные ионы.
С другой стороны, атомы неметаллов, такие как кислород, фтор или карбон, имеют тенденцию принимать электроны от атомов металла. Эти неметаллы обладают высокой электроотрицательностью и имеют тенденцию стать отрицательно заряженными ионами или анионами. Принятие электронов от атомов металла позволяет атомам неметалла образовать стабильные ионы и установить ионную связь.
Таким образом, передача или отдача электронов играет важную роль в образовании ионной связи. Она позволяет атомам металлов и неметаллов образовывать стабильные ионы, что обеспечивает электронный баланс и химическую стабильность вещества.
Особенности атомов металлов

1. Электронная конфигурация
Атомы металлов обладают особенной электронной конфигурацией, которая позволяет им образовывать ионную связь. Внешний электронный уровень у металлов обычно содержит мало электронов, что делает их более склонными к отдаче электронов.
2. Ионизационная энергия
Металлы характеризуются низкой ионизационной энергией, что означает, что энергия, необходимая для отделения одного электрона от атома металла, относительно невелика. Это способствует процессу отдачи электронов при образовании ионной связи.
3. Металлическая структура
Атомы металлов обычно образуют кристаллическую структуру, в которой положение и связи атомов характеризуются высоким порядком. Это позволяет атомам металлов образовывать устойчивые и прочные ионные связи с другими атомами.
4. Валентность
Металлы обладают переменной валентностью - способностью изменять количество отдаваемых электронов. Это свойство атомов металлов позволяет им образовывать различные ионы при образовании ионной связи.
5. Формирование положительного иона
При образовании ионной связи, атом металла обычно отдает один или несколько электронов, и становится положительно заряженным ионом. Электроны, отданные атомом металла, занимают область свободной проводимости, что определяет его металлические свойства.
Атомы металлов и проводимость
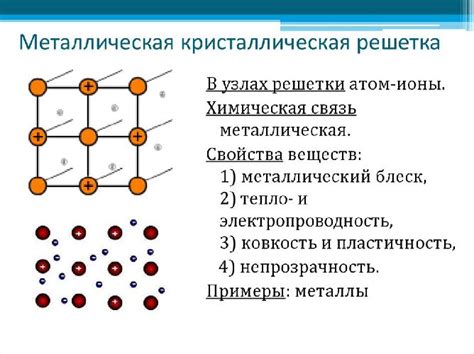
Атомы металлов при образовании ионной связи обычно отдают электроны. Это происходит, потому что валентные электроны атомов металлов находятся в внешней оболочке и легко могут участвовать в химических реакциях. Отдача электронов позволяет атомам металлов образовывать положительно заряженные ионы, которые составляют кристаллическую решетку металлического материала.
Ионная связь, формирующаяся между атомами металлов и неметаллов, обладает специфическими свойствами. Одно из них - высокая проводимость электрического тока. Положительно заряженные ионы металла в кристаллической решетке образуют группы, которые под действием внешнего электрического поля легко перемещаются. Это позволяет электронам свободно двигаться по материалу и принимать или отдавать электроны другим атомам.
Передвижение электронов в металлическом материале является основой электрической проводимости. Благодаря этому металлы обладают высокой электропроводностью и широко применяются в различных областях, включая электротехнику, электронику и силовую инженерию.
Однако проводимость металлов может быть изменена в результате добавления примесей или влияния внешних факторов. Например, добавление других элементов может создавать дефекты в кристаллической структуре металла, что ведет к снижению проводимости. Также тепло или магнитное поле могут влиять на движение электронов и изменять электрические свойства материала. Изучение и контроль проводимости металлов имеют важное значение для разработки новых материалов и улучшения существующих технологий.
Электроотрицательность атомов металлов

Электроотрицательность атомов металлов является важным показателем при образовании ионной связи. Электроотрицательность – это способность атома притягивать к себе электроны.
Металлы обладают малой электроотрицательностью, поскольку их атомы имеют большой радиус и малое количество электронов в внешней оболочке. Это позволяет атомам металлов легко отдавать электроны и образовывать положительные ионы – катионы. Данное явление объясняется тем, что атомы металлов стремятся достичь стабильного электронного строения.
Положительно заряженные катионы металлов притягивают отрицательно заряженные анионы неметаллов при образовании ионной связи. Таким образом, происходит образование кристаллической решетки, в которой положительные ионы располагаются регулярно в решетке, а отрицательные ионы заполняют свободные места между ними.
Ионная связь между металлами и неметаллами является одной из самых сильных связей. Она обладает большой прочностью и обеспечивает устойчивость соединений. Именно благодаря этому свойству ионной связи металлы обладают высокой теплопроводностью и электропроводностью, а также могут образовывать кристаллические решетки с различными свойствами.
Влияние внешних условий на образование ионной связи

Образование ионной связи в металлах зависит от различных внешних условий, которые могут повлиять на процесс отдачи или приема электронов атомами металлов. Один из важных факторов – электрическое поле, которое может существовать в окружающей среде.
При наличии электрического поля атомы металлов, обладающие свободными электронами, будут смещаться в направлении поля. Если на атомы действует поле с отрицательным зарядом, они будут приобретать положительный заряд, отдавая свои электроны, чтобы нейтрализовать заряд поля. Если на атомы действует поле с положительным зарядом, они будут притягивать свободные электроны из окружающей среды, чтобы нейтрализовать заряд поля.
Температура также может оказывать влияние на образование ионной связи. При повышении температуры атомы металлов приобретают большую энергию, что увеличивает вероятность отдачи электронов. Это происходит из-за того, что при повышенной температуре электроны получают больше энергии для преодоления электростатического притяжения с ядром атома.
Ионная связь также зависит от размеров атомов металла. Если атом имеет больший радиус, то у него будет слабее притяжение электронов к ядру, что облегчит отдачу электронов. Если атом имеет маленький радиус, то притяжение электронов будет сильнее, что будет способствовать приему электронов.
Таким образом, внешние условия, такие как наличие электрического поля, температура и размеры атомов металла, могут оказывать существенное влияние на процесс образования ионной связи. Обратимое превращение металлов в ионы и обратно возможно при изменении этих условий.
Вопрос-ответ

Атомы металлов при образовании ионной связи отдают или принимают электроны?
При образовании ионной связи атомы металлов отдают электроны. Это происходит из-за того, что атомы металлов имеют небольшое количество электронов во внешнем энергетическом уровне, и они легко отдают эти электроны, чтобы стать положительно заряженными ионами.
Какие атомы металлов отдают электроны при образовании ионной связи?
Атомы металлов, которые отдают электроны при образовании ионной связи, имеют небольшое количество электронов во внешнем энергетическом уровне. В основном, это атомы алкалинных металлов, таких как литий, натрий, калий, рубидий и цезий.
Почему атомы металлов отдают электроны, а не принимают?
Атомы металлов отдают электроны при образовании ионной связи, потому что они имеют небольшое количество электронов во внешнем энергетическом уровне. Это связано с электронной конфигурацией атома металла, где энергетический уровень, на котором находятся внешние электроны, достаточно далек от ядра, что делает их легкими для отдачи.
А на каком основании атомы металлов отдают электроны?
Атомы металлов отдают электроны при образовании ионной связи на основании электронной конфигурации. У металлов на внешнем энергетическом уровне находится небольшое количество электронов, что делает их легкими для отдачи. Кроме того, отдача электронов позволяет атомам металлов достичь стабильности, превратившись в положительно заряженные ионы.
