Азотная кислота (HNO3) является одним из самых сильных окислителей и широко используется в химической промышленности и лабораториях. Она обладает высокой активностью и может взаимодействовать с различными веществами, в том числе с металлами. Взаимодействие металлов с концентрированной азотной кислотой приводит к образованию солей, которые могут иметь важное промышленное и научное применение.
В процессе взаимодействия активных металлов с азотной кислотой происходит окисление металла и превращение его в соответствующие соли. Данная реакция является реакцией окисления-восстановления и исходные металлы действуют в качестве восстановителей, а азотная кислота - в качестве окислителя. При этом выделяется большое количество теплоты, что сопровождается характерным шипением и пульсацией цвета реагирующей смеси.
Особенно заметной реакцией является взаимодействие цинка (Zn) с азотной кислотой. При этом образуется нитрат цинка (Zn(NO3)2) и выделяется диоксид азота (NO2). Однако, не все металлы могут эффективно взаимодействовать с азотной кислотой, так как некоторые из них образуют защитную пленку оксида на своей поверхности, что способствует замедлению или полному прекращению реакции.
Взаимодействие металлов с концентрированной азотной кислотой - важная химическая реакция, которая имеет широкое применение в различных областях научных и промышленных исследований. Понимание этого процесса позволяет углубить знания о взаимодействии различных веществ и представляет интерес для разработки новых материалов и технологий.
Взаимодействие металлов с концентрированной азотной кислотой

Азотная кислота (HNO3) является сильным окислителем и реагирует с различными металлами. В результате взаимодействия происходит образование солей металлов нитратов.
Взаимодействие металлов с концентрированной азотной кислотой происходит на принципе окислительно-восстановительной реакции, где металл обеспечивает процесс восстановления, а азотная кислота - окисления. Образующиеся нитраты обладают высокой степенью растворимости и могут быть использованы в различных областях химии и промышленности.
Взаимодействие цинка (Zn) с азотной кислотой:
- При взаимодействии цинка с азотной кислотой образуется нитрат цинка (Zn(NO3)2) и обильно выделяется оксид азота (NO).
- Реакция протекает с выделением тепла и сопровождается плавящимся цинком и выделением газа.
Взаимодействие железа (Fe) с азотной кислотой:
- Взаимодействие железа с азотной кислотой происходит при разных температурах и концентрациях.
- При комнатной температуре взаимодействие протекает медленно и требует присутствия катализаторов, таких как платина или платиновый черный.
- При нагревании сильно концентрированной азотной кислоты взаимодействие протекает более быстро и может сопровождаться вспышкой и дымообразованием.
- Результатом реакции является образование нитрата железа (Fe(NO3)2).
Известно, что металлы, такие как медь (Cu), свинец (Pb) и магний (Mg), не реагируют с концентрированной азотной кислотой в обычных условиях. Однако при определенных условиях и концентрациях азотной кислоты, эти металлы также могут образовывать нитраты.
Металлы и азотная кислота

Азотная кислота (HNO3) - одна из самых сильных кислот, которая обладает высокой реакционной способностью. Она широко используется в различных отраслях промышленности и лабораторной практике. При взаимодействии металлов с концентрированной азотной кислотой, образуются соли, которые представляют собой важные соединения с использованием в различных областях науки и техники.
Взаимодействие металлов с азотной кислотой протекает по реакции окисления-восстановления. Металлы отдают электроны кислороду кислоты, образуя положительно заряженные ионы металла и воду. Кислород азотной кислоты, в свою очередь, принимает электроны от металла и вступает в редукционную реакцию, образуя отрицательно заряженные ионы. Таким образом, происходит образование солей металлов и азотной кислоты - нитратов.
Нитраты широко используются в сельском хозяйстве в качестве удобрений, так как они являются источником доступного для растений азота. Они также находят применение в производстве взрывчатых веществ, красителей, стекла и других отраслях промышленности. В лабораторной практике нитраты используются для получения других соединений, а также в качестве реактивов и индикаторов при проведении различных химических анализов.
Важно отметить, что некоторые металлы не взаимодействуют с азотной кислотой или вступают в реакцию с выделением большого количества тепла. Также, стоит учитывать, что взаимодействие металлов с концентрированной азотной кислотой может быть опасным в силу высокой реакционной способности кислоты, поэтому при проведении таких экспериментов необходимо соблюдать все меры безопасности.
Реакции между металлами и азотной кислотой
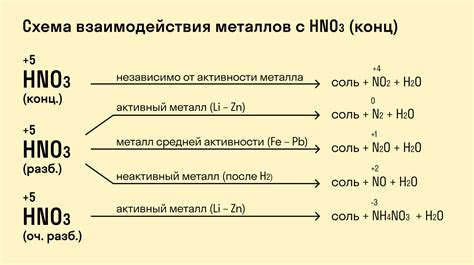
Взаимодействие металлов с концентрированной азотной кислотой приводит к образованию солей и выделению водорода. Такие реакции являются химическими окислительно-восстановительными процессами.
Реакции с металлами различаются в зависимости от их активности. Активные металлы, такие как натрий, калий, магний, алюминий и цинк, образуют соли азотной кислоты с выделением водорода. Например, реакция натрия с азотной кислотой происходит следующим образом: Na + HNO3 → NaNO3 + H2.
Реакция азотной кислоты с менее активными металлами, такими как железо, медь и свинец, может быть разнообразной. В этом случае образуются различные нитраты металлов, при этом некоторые металлы могут выделяться в виде нитритов или оксидов. Например, реакция азотной кислоты с железом может привести к образованию нитрата железа, но также возможна реакция, при которой образуется нитрит железа: Fe + 4HNO3 → Fe(NO3)2 + 2NO2 + 2H2O.
Уравновешенные химические уравнения позволяют описать реакции между металлами и азотной кислотой, определяют количество веществ и направление химического процесса. Отношение между металлами и азотной кислотой является важной частью изучения химии и может применяться в различных отраслях промышленности, например, в производстве удобрений или в химическом анализе.
Образование солей
Соли - это химические соединения, образующиеся при взаимодействии металлов с концентрированной азотной кислотой. Этот процесс называется окислительной реакцией. Изначально металлы находятся в виде ионов, а азотная кислота выступает в качестве окислителя.
Образование солей происходит следующим образом. При смешении металла с концентрированной азотной кислотой происходит окисление металла, а кислород и водород выделяются в газообразном состоянии. В результате образуется соль, которая состоит из катиона металла и аниона азотной кислоты.
Примером такой реакции может служить взаимодействие меди (Cu) с азотной кислотой (HNO3). При смешении этих веществ происходит образование соли меди (II) нитрат (Cu(NO3)2) и выделение водорода (H2) в виде газа.
Образование солей имеет большое практическое значение. Соли широко применяются в различных отраслях промышленности, медицине, сельском хозяйстве и др. Кроме того, из солей можно получать металлы и использовать их в производственных целях. Например, цинк (Zn) получают из соли цинка (ZnSO4) методом электролиза.
Образование солей является одной из важных реакций в химической науке и промышленности. Оно позволяет получать новые вещества с определенными свойствами, которые находят применение в различных областях человеческой деятельности.
Применение полученных соединений
Соли, полученные в результате взаимодействия металлов с концентрированной азотной кислотой, имеют широкий спектр применения в различных отраслях промышленности и научных исследований.
Одним из основных применений данных соединений является их использование в процессе производства удобрений. Многие соли, такие как нитраты калия, аммония, кальция и магния, являются важными компонентами удобрений, благодаря своей способности обеспечивать растения необходимыми питательными веществами для роста и развития.
Кроме того, некоторые соли металлов с азотной кислотой нашли применение в процессе производства пигментов для красок и красителей. Например, соль нитрата свинца используется для получения желтого пигмента, а соль нитрата стронция - для получения красного пигмента.
Еще одним областью применения таких соединений является производство взрывчатых веществ и пиротехнических составов. Многие соли, особенно нитраты и нитриты, могут быть использованы в качестве окислителей в различных взрывных и огнетушительных смесях.
Также стоит отметить, что полученные соединения могут применяться в химическом анализе для детектирования определенных веществ или процессов. Например, соль азотнокислого никеля используется для обнаружения наличия аммиака в пробе воздуха.
Вопрос-ответ

Какое взаимодействие металлов с концентрированной азотной кислотой происходит?
Взаимодействие металлов с концентрированной азотной кислотой приводит к образованию солей. Это происходит из-за окислительных свойств азотной кислоты, которая отбирает электроны у металла.
Какие металлы могут образовывать соли с азотной кислотой?
Многие металлы могут образовывать соли с азотной кислотой, включая щелочные и щелочноземельные металлы, а также некоторые переходные металлы. Например, натрий, калий, магний, цинк, железо и медь.
Какие свойства солей, образующихся при взаимодействии металлов с азотной кислотой?
Соли, образующиеся при взаимодействии металлов с азотной кислотой, обычно имеют высокую степень растворимости и обладают специфическими физическими и химическими свойствами. Например, многие из них являются кристаллическими соединениями и обладают яркими цветами.
Какие металлы реагируют с азотной кислотой с большим выделением газа?
Активные металлы, такие как натрий и калий, реагируют с азотной кислотой с большим выделением газа. При этом образуется оксид азота и соответствующая соль металла. Такая реакция часто сопровождается плаванием металла в кислоте и выделением фонтана азотного газа.
Может ли взаимодействие металлов с азотной кислотой привести к взрыву?
Да, взаимодействие некоторых металлов с концентрированной азотной кислотой может привести к взрыву. Например, при контакте алюминия с азотной кислотой выделяется азотистый газ, который имеет способность взрываться при определенных условиях. Поэтому необходимо соблюдать предосторожность при работе с азотной кислотой и металлами.
