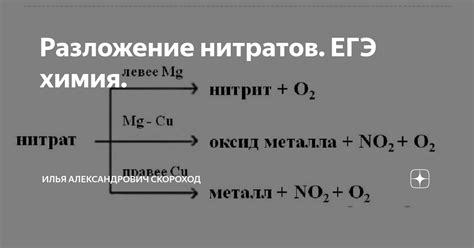
Разложение нитратов металлов при нагревании является одним из способов получения оксидов металлов. Нитраты металлов - это соли, в состав которых входит анион нитрата (NO3-). При нагревании нитраты металлов происходит окислительно-восстановительная реакция, в результате которой образуются оксиды металлов и выделяется газовый продукт.
Разложение нитратов металлов происходит при температурах выше 200 градусов Цельсия. При нагревании нитрат металла распадается на оксид металла и кислород. Оксид металла является конечным продуктом разложения нитрата металла и может иметь различные цвета и свойства. Например, разложение нитрата меди Cu(NO3)2 при нагревании приводит к образованию черного оксида меди CuO, а разложение нитрата железа Fe(NO3)3 - к образованию красного оксида железа Fe2O3.
Образование оксидов при разложении нитратов металлов при нагревании является важным процессом в химической промышленности и лабораторной практике. Оксиды металлов, полученные путем разложения нитратов, находят широкое применение в различных отраслях, таких как катализ, электрохимия, материаловедение и др. Понимание этого процесса позволяет улучшить методы получения и использования оксидов металлов.
Влияние нагревания на разложение нитратов металлов
Разложение нитратов металлов при нагревании является важным процессом, оказывающим значительное влияние на образование оксидов. При нагревании нитраты металлов распадаются на оксиды металлов и еще одну или несколько молекул кислорода, что приводит к образованию характерных окислительных соединений. Этот процесс является одним из способов получения оксидов металлов.
Температура нагревания играет важную роль в разложении нитратов металлов. При повышении температуры происходит активация процесса разложения, что приводит к более интенсивному образованию оксидов. Однако, при слишком высоких температурах может происходить углерожение некоторых нитратов или разложение оксидов металлов.
Разложение нитратов металлов при нагревании также зависит от их химической структуры и свойств. Например, нитраты некоторых металлов обладают высокой термической стабильностью и требуют более высоких температур для своего разложения. Это может быть связано с наличием дополнительных групповых ионов или орто- и пиросоединений в составе нитратов.
Изучение влияния нагревания на разложение нитратов металлов имеет практическую значимость для синтеза и получения различных оксидов металлов. Исследование условий и параметров нагревания позволяет контролировать процесс разложения и получать требуемые оксиды с определенными свойствами. Таким образом, понимание механизма и влияния нагревания на разложение нитратов металлов является важным вкладом в развитие химической науки и промышленности.
Роль оксидов в процессе разложения
Разложение нитратов металлов при нагревании является одним из способов получения оксидов этих металлов. Оксиды играют важную роль в различных областях, включая промышленность, медицину и науку.
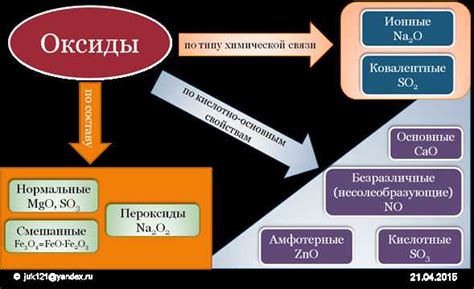
Оксиды обладают различными физическими и химическими свойствами, которые зависят от состава и структуры молекул. Они могут быть кислотными, основными или нейтральными в зависимости от их реакции с водой. Также оксиды могут быть проводниками электричества или являться диэлектриками.
Разложение нитратов металлов позволяет получить оксиды с определенными свойствами, которые позволяют использовать их в различных областях. Например, оксиды железа используются в производстве стали и магнитов, оксиды алюминия - в производстве алюминиевых изделий и керамики, оксиды цинка - в гальванической и электронной промышленности.
Оксиды имеют также важное значение в химических реакциях и каталитических процессах. Они могут служить катализаторами при синтезе органических соединений, а также участвовать в процессах окисления и снижения. Например, оксид меди используется в качестве катализатора при производстве метанола.
Таким образом, разложение нитратов металлов и образование оксидов является важным процессом, который позволяет получить вещества с уникальными свойствами, необходимыми в различных отраслях промышленности и науки.
Причины образования оксидов
Образование оксидов при разложении нитратов металлов при нагревании происходит из-за химических реакций, происходящих в результате изменения окружающей среды и высоких температур.
Один из основных факторов образования оксидов - это окислительные свойства нитратов. При нагревании нитраты металлов подвергаются разложению, превращаясь в соответствующие оксиды. Данная реакция происходит из-за наличия кислорода в нитратных группах, который играет роль окислителя.
Важную роль в образовании оксидов также играет температура. При нагревании нитратов металлов до достаточно высоких температур, молекулы нитратов расщепляются, освобождая кислород и формируя оксиды. Высокая температура является необходимым условием для проведения данной реакции.
Кроме того, при образовании оксидов могут играть роль и другие факторы, такие как наличие веществ, которые могут ускорить реакцию разложения нитратов или образования оксидов. Например, использование катализаторов или добавление определенных компонентов может способствовать образованию оксидов при нагревании.
Химические свойства образованных оксидов

Образование оксидов при разложении нитратов металлов при нагревании является важной реакцией в химии. После образования оксидов, эти соединения обладают рядом химических свойств, которые определяют их применение и роль в различных процессах.
Первое свойство, которое характеризует образованные оксиды, это их степень окисления. Степень окисления металла в оксиде может быть определена по формуле данного оксида. Например, окись алюминия имеет формулу Al2O3, где алюминий имеет степень окисления +3. Эта информация играет важную роль в определении химической активности и свойств оксида.
Другим важным свойством образованных оксидов является их растворимость. Некоторые оксиды металлов растворяются в воде и образуют основания. Например, оксид натрия (Na2O) растворяется в воде, образуя раствор сильной щелочи – гидроксида натрия (NaOH). Эти основания могут использоваться в различных процессах, включая производство мыла и очистку воды.
Образованные оксиды металлов также обладают кислотными свойствами и могут реагировать с кислородсодержащими соединениями. Некоторые оксиды, такие как окись серы (SO2), являются газами и имеют характерный запах. Они реагируют с водой и образуют кислоты, такие как серная кислота (H2SO4), которая широко используется в промышленности.
Образованные оксиды металлов могут также реагировать с другими соединениями, образуя различные соли. Например, оксид железа (III) (Fe2O3), реагируя с кислотой соляной, образует соль – хлорид железа (III) (FeCl3), которая используется в качестве катализатора и в других химических процессах.
Влияние температуры на образование оксидов

Образование оксидов при разложении нитратов металлов при нагревании – это важный процесс, который может происходить при различных температурах. Температура играет ключевую роль в определении формы и структуры оксидов, а также их свойств и характеристик.
При нагревании нитратов металлов до определенной температуры происходит окислительно-восстановительная реакция, в результате которой образуются соответствующие оксиды. Температура разложения нитратов зависит от свойств и химической природы конкретного металла. Например, нитраты легких металлов, таких как натрий и калий, обычно разлагаются при достаточно низких температурах (от 300 до 400 °C), в то время как нитраты тяжелых металлов, например, свинца или меди, требуют более высоких температур (от 500 до 800 °C).
Повышение температуры влияет на скорость разложения нитратов и образование оксидов. Высокая температура позволяет повысить энергию активации реакции и ускоряет процесс. Однако, слишком высокие температуры могут также способствовать другим побочным процессам, например, испарению и заражению оксидов воздухом, что может повлиять на их чистоту и структуру. Поэтому оптимальная температура для образования оксидов должна быть выбрана соответствующим образом.
Таким образом, температура играет важную роль в образовании оксидов при разложении нитратов металлов при нагревании. Правильный выбор температуры позволяет оптимизировать процесс и получить оксиды с нужными свойствами и характеристиками. При этом необходимо учитывать химическую природу металла и его нитрата, а также желаемые свойства оксида.
Особенности образования оксидов различных металлов

Натрий:
При нагревании нитрата натрия (NaNO3) образуется оксид натрия (Na2O), который является безцветным кристаллическим веществом с плавающей точкой 2775 °C. Оксид натрия обладает высокой щелочностью и используется в промышленности при производстве мыла и стекла.
Калий:
Разложение нитрата калия (KNO3) при нагревании приводит к образованию оксида калия (K2O). Оксид калия также является безцветным соединением и обладает аналогичными свойствами с оксидом натрия. Он широко используется в качестве щелочи и в производстве стекла и мыла.
Магний:
При нагревании нитрата магния (Mg(NO3)2) образуется оксид магния (MgO), который является белым порошком. Оксид магния обладает высокой степенью огнеупорности и используется в производстве огнеупорных материалов, в том числе в производстве огнеупорного кирпича и стекловолокна.
Алюминий:
При разложении нитрата алюминия (Al(NO3)3) образуется оксид алюминия (Al2O3), который называется алюминием. Алюминий имеет белый цвет и обладает высокой степенью твердости. Он широко используется в производстве металла алюминия, а также в строительстве и авиационной промышленности.
Железо:
При нагревании нитрата железа (Fe(NO3)3) образуется оксид железа (Fe2O3), который имеет красно-коричневый цвет и называется гематитом. Оксид железа является одним из основных источников железа в природе и широко используется в производстве стали и других металлических сплавов.
Медь:
При нагревании нитрата меди (Cu(NO3)2) образуется оксид меди (CuO), который имеет чёрный цвет. Оксид меди обладает проводимостью электрического тока и применяется в электротехнике, а также в производстве керамики и жаростойкой краски.
Цинк:
При разложении нитрата цинка (Zn(NO3)2) образуется оксид цинка (ZnO), который является белым порошком. Он широко используется в производстве косметических средств, ветошей и лекарственных препаратов, а также в производстве резиновых изделий и керамики.
Методы исследования образования оксидов

Образование оксидов при разложении нитратов металлов при нагревании изучается с помощью различных методов исследования. Одним из таких методов является термический анализ. Он позволяет определить температуру, при которой происходит разложение нитрата и образование соответствующего оксида.
Для проведения термического анализа используют специальные приборы, например, термогравиметр и диференциальный сканирующий калориметр. С помощью термогравиметра можно определить изменение массы образца при нагревании, что связано с выделением газов при разложении нитрата и образовании оксида. Диференциальный сканирующий калориметр, в свою очередь, позволяет измерить изменение теплоемкости при нагревании образца, что дает информацию о термических эффектах, связанных с образованием оксида.
Кроме термического анализа, для изучения образования оксидов применяют также рентгеноструктурный анализ, который позволяет определить структуру образцов и выявить присутствие оксидов. Для этого используется рентгеновское излучение, которое рассеивается кристаллическим образцом и формирует дифракционную картину, на основе которой можно сделать выводы о структуре и наличии определенных соединений.
Кроме перечисленных методов, существует также ряд других подходов к исследованию образования оксидов при разложении нитратов металлов при нагревании. Важными являются такие методы, как спектроскопия, масс-спектрометрия и электрохимические методы. Они позволяют изучать различные физико-химические свойства оксидов, их состав и структуру.
Применение образованных оксидов в различных отраслях
Оксиды, образующиеся при разложении нитратов металлов при нагревании, широко используются в различных отраслях промышленности и науки. Ниже перечислены некоторые области применения этих оксидов:
1. Металлургия: Многие оксиды, получаемые в результате нагревания нитратов металлов, используются в металлургической промышленности. Например, оксид железа (Fe2O3) используется для производства стали и различных сплавов. Оксид магния (MgO) используется в процессе производства магниевых сплавов и реактивов.
2. Электроника и полупроводники: Некоторые оксиды, такие как оксид кремния (SiO2) и оксид алюминия (Al2O3), широко применяются в производстве электроники и полупроводников. Оксид кремния используется для создания изолирующих слоёв на кремниевых чипах, а оксид алюминия – для создания диэлектрических пленок и промежуточных слоёв.
3. Керамика и стекло: Некоторые оксиды металлов имеют высокую термостойкость и используются в производстве керамики и стекла. Например, оксид алюминия (Al2O3) используется для создания термостойких керамических изделий и огнеупорных материалов. Оксид свинца (PbO) применяется для улучшения оптических свойств стекла.
4. Катализаторы: Некоторые оксиды металлов обладают каталитическими свойствами и широко применяются в производстве катализаторов. Например, оксид меди (CuO) используется в катализаторах для осуществления реакций окисления и гидрогенирования.
5. Медицина: Некоторые оксиды металлов имеют антимикробные и антисептические свойства и применяются в медицине. Оксид цинка (ZnO) используется в качестве активного ингредиента в солнцезащитных средствах и противовоспалительных мазях.
6. Красители и пигменты: Некоторые оксиды металлов имеют яркие цвета и используются в производстве красителей и пигментов. Например, оксид железа (Fe2O3) используется в производстве красок, пигментов и косметических средств.
Таким образом, образованные оксиды при разложении нитратов металлов при нагревании находят широкое применение в металлургии, электронике, керамической и стекольной промышленности, производстве катализаторов, медицине, а также в производстве красителей и пигментов.
Построение реакционных механизмов образования оксидов
Образование оксидов при разложении нитратов металлов при нагревании происходит в результате последовательных химических реакций. Реакционные механизмы образования оксидов различных металлов могут отличаться друг от друга в зависимости от свойств и структуры соответствующих нитратов.
Одним из механизмов образования оксида является разложение нитратов на оксиды и кислород. Например, при нагревании нитрата калия (KNO3), происходит его распад на оксид калия (K2O) и кислород (O2). Это реакция, которая происходит при высоких температурах и в присутствии катализаторов.
Еще один механизм образования оксидов связан с процессом дезаммонификации при нагревании некоторых нитратов. Например, при нагревании нитрата меди (Cu(NO3)2), происходит разложение нитрата и выделение из него двуокиси меди (CuO). В ходе реакции нитратный радикал выступает в качестве кислородного агента и оксид металла образуется самопроизвольно.
Еще одним механизмом образования оксидов является термическое разложение некоторых нитратов без образования кислорода. Например, при нагревании нитрата свинца (Pb(NO3)2) происходит разложение нитрата с образованием оксида свинца (PbO). В данном случае, нагревание ведется до температуры, при которой происходит термическое разложение нитрата без дополнительного разложения на кислород.
Таким образом, образование оксидов при разложении нитратов металлов при нагревании зависит от их химического состава и условий проведения реакции. Различные механизмы образования оксидов позволяют получать разнообразные соединения с определенными свойствами и применением.
Вопрос-ответ

Какие оксиды могут образовываться при разложении нитратов металлов при нагревании?
При разложении нитратов металлов могут образовываться различные оксиды, в зависимости от металла. Например, при нагревании нитрата натрия (NaNO3) образуется оксид натрия (Na2O), а при нагревании нитрата железа (Fe(NO3)3) образуется оксид железа (Fe2O3).
Как происходит разложение нитратов металлов при нагревании?
При нагревании нитраты металлов разлагаются, выделяя кислород и образуя соответствующие оксиды металлов. Например, нитрат натрия (NaNO3) при нагревании распадается на оксид натрия (Na2O) и кислород (O2). Этот процесс называется термическим разложением.
