Щелочные металлы - это элементы, которые входят в первую группу периодической системы. В их число входят литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают рядом уникальных свойств, которые делают их особенными и интересными для исследования. Например, они являются самыми легкими металлами и характеризуются низкой плотностью.
Одним из наиболее известных свойств щелочных металлов является их способность реагировать с водой. Этот процесс сопровождается выделением водорода и образованием гидроксида щелочного металла. Например, реакция калия с водой проходит с огнем и является очень впечатляющей. В результате образуется гидроксид калия (крахмал) и очень высокая температура.
Щелочные металлы также обладают высокой химической реактивностью и богатой химической активностью. Это позволяет им образовывать различные соединения с другими элементами, такие как кислород, сера, фосфор и даже более сложные органические соединения. Благодаря этим свойствам щелочные металлы широко используются в различных отраслях промышленности, включая производство фармацевтических препаратов, стекла и сплавов.
Важно отметить, что щелочные металлы являются очень реактивными и реагируют с воздухом и водой. Они лишены защитной оксидной пленки, что делает их очень восприимчивыми к окислению и коррозии. Поэтому щелочные металлы хранят в жидком аммиаке или масле, чтобы предотвратить контакт с кислородом. Несмотря на это, они остаются очень важными элементами в химии и науке благодаря своим уникальным свойствам.
Высокая реактивность и горение на воздухе

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, характеризуются высокой реактивностью и способностью гореть на воздухе. Эти свойства обусловлены их низкой ионизационной энергией и активностью электронов во внешней оболочке.
Когда металлические атомы щелочных металлов вступают в реакцию с кислородом воздуха, они образуют оксиды. Наиболее известен оксид лития (Li2O), который образуется при воздействии кислорода на литий. При этом происходит свободное горение металла, сопровождающееся ярким пламенем.
Такое горение щелочных металлов на воздухе носит самозажигательный характер. Она начинается при контакте металла с кислородом и продолжается без внешнего источника огня. Формирующаяся на поверхности металла оксидная пленка обладает высокой термической стабильностью, что позволяет горению протекать с высокой тепловой интенсивностью.
Это свойство щелочных металлов используется в различных приложениях, включая пиротехнику, аккумуляторы и химическую промышленность. Кроме того, высокая реактивность и горение на воздухе делают щелочные металлы опасными в обращении и требуют соблюдения предосторожности при работе с ними.
Реакции с водой и образование щелочи
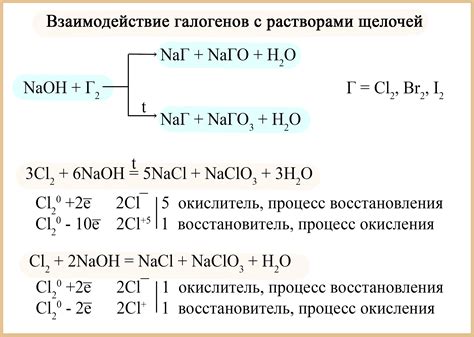
Щелочные металлы, такие как литий, натрий и калий, обладают уникальными свойствами взаимодействия с водой. При контакте с водой они активно реагируют, образуя щелочные растворы.
В результате реакции с водой, между металлом и водой происходит обмен протонами. Активное металлическое ион производит водород, а протон переходит в раствор, образуя гидроксид щелочного металла. Поэтому, как правило, в результате этой реакции образуется щелочный раствор.
Образование щелочи при взаимодействии с водой делает щелочные металлы важными для многих процессов, как в лабораторных условиях, так и в промышленности. Щелочные растворы используются в процессе обезжиривания, чистки и дезинфекции поверхностей, а также в производстве мыла и других моющих средств.
Щелочные металлы также могут реагировать с газообразным водородом при высоких температурах, образуя гидриды щелочных металлов. Это важные соединения, которые используются в различных областях, включая химическую промышленность и электроэнергетику.
Кроме воды, щелочные металлы также могут реагировать с растворами кислот, образуя соль и водород. Эти реакции играют важную роль в химических процессах и могут быть использованы для получения различных продуктов.
Комбинирование с кислородом и образование оксидов

Щелочные металлы, такие как литий, натрий и калий, активно комбинируются с кислородом, что приводит к образованию оксидов. Оксиды щелочных металлов обладают рядом уникальных свойств и находят широкое применение в различных отраслях.
Первым щелочным металлом, достаточно активно реагирующим с кислородом, является литий. При контакте с воздухом он образует оксид лития (Li2O), который является безцветным кристаллическим веществом. Оксид лития обладает высокой ионным проводимостью и используется в производстве литий-ионных аккумуляторов.
Натрий также комбинируется с кислородом, образуя оксид натрия (Na2O). Этот оксид является базовым и сильно гигроскопичен, то есть способен впитывать и удерживать воду. Из-за этой способности, оксид натрия находит применение в производстве щелочи и стекловарении.
Калий образует оксид калия (K2O), который является еще более реактивным, чем оксид натрия. Он используется в производстве катализаторов, керамики и огнеупорных материалов.
Образование сплавов с другими металлами

Щелочные металлы, такие как литий, натрий, калий, имеют способность образовывать сплавы с другими металлами. Это связано с их уникальными физическими и химическими свойствами. Сплавы щелочных металлов с другими металлами обладают интересными применениями в различных областях науки и техники.
Образование сплавов с другими металлами позволяет модифицировать и улучшить свойства материалов. Например, сплавы лития с алюминием обладают повышенной прочностью и легкостью, что делает их идеальным материалом для производства легких и прочных конструкций, например, в авиации или автомобильной промышленности.
Сплавы натрия с другими металлами часто используются в электротехнике и электронике. Натрий-металлгидридные аккумуляторы, содержащие сплавы натрия с литием, обладают высокой энергетической плотностью, что позволяет использовать их в электромобилях и других устройствах, где важна долговременная работа без подзарядки.
Калий, в свою очередь, также образует сплавы с различными металлами. Сплавы калия с алюминием или цезием, например, используются в солнечных батареях для преобразования солнечной энергии в электричество.
Образование сплавов щелочных металлов с другими металлами является важным направлением в материаловедении и технике. Подобные сплавы обладают уникальными свойствами, которые находят применение в различных сферах человеческой деятельности - от производства автомобилей и самолетов до создания солнечных батарей и аккумуляторов.
Способность к образованию ионов в растворах

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой способностью к образованию ионов в растворах. За счет своей химической активности они легко реагируют с водой, образуя гидроксиды. При этом, металлы способны выделяться в виде положительно заряженных ионов, которые взаимодействуют с отрицательно заряженными ионами водорода и образуют гидроксидные ионы.
Это свойство щелочных металлов является основой для их широкого применения в различных областях. Гидроксиды щелочных металлов являются важными компонентами в процессе производства щелочных и щелочно-земельных стекол, мыла и моющих средств, а также в производстве щелочных батарей. Они также играют важную роль в химической промышленности, используются для нейтрализации кислот или для регулирования рН растворов.
Благодаря способности к образованию ионов в растворах, щелочные металлы также проявляют амфотерные свойства. Это значит, что они могут реагировать не только с кислотами, но и с основаниями. В результате таких реакций образуются соли, которые являются основами или кислотами в зависимости от условий реакции.
Для учета способности щелочных металлов к образованию ионов в растворах используется понятие "ионная сила". Это величина, которая определяет концентрацию ионов в растворе и является показателем электролитической активности. Щелочные металлы обладают высокой ионной силой, что делает их особо реактивными в химических реакциях и влияющими на свойства растворов, в которых они находятся.
Ядерные реакции с участием щелочных металлов
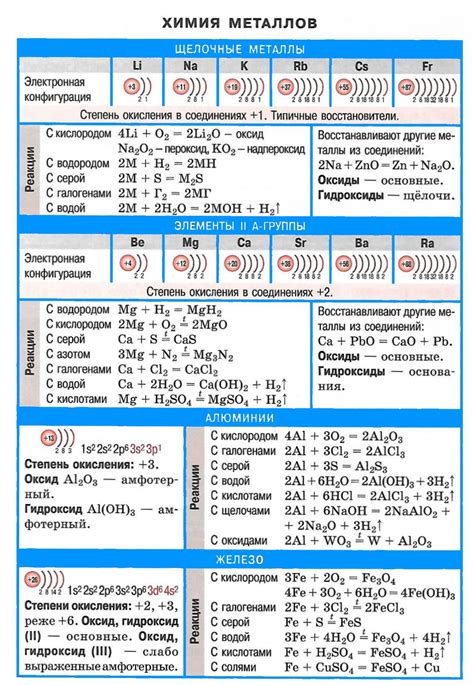
Щелочные металлы, такие как литий, натрий, калий и др., имеют уникальные свойства, которые позволяют использовать их в ядерных реакциях. Одним из таких свойств является возможность щелочных металлов активно участвовать в ядерных реакциях, образуя новые элементы.
Возможность щелочных металлов быть использованными в ядерных реакциях связана с их способностью образовывать стабильные ядерные соединения с другими элементами. Например, литий может служить источником тепла и энергии в ядерных реакциях, таких как термоядерный синтез, где происходит слияние ядер водорода для образования ядра гелия.
Важным свойством щелочных металлов в ядерных реакциях является их способность быть использованными как модераторы, то есть вещества, замедляющие скорость ядерных реакций. Например, натрий может быть использован в качестве модератора в тепловых ядерных реакторах, где происходят деление ядерных топливных элементов, таких как уран или плутоний.
Ядерные реакции с участием щелочных металлов также могут применяться в медицине. Например, калий может быть использован в радиоизотопной терапии для лечения определенных видов рака. При этом в организм вводятся радиоактивные изотопы калия, которые затем сосредотачиваются в опухоли и разрушают раковые клетки.
Таким образом, использование щелочных металлов в ядерных реакциях открывает широкие возможности для получения энергии, исследования элементарных частиц, а также лечения некоторых заболеваний. Это наглядно демонстрирует необычные свойства и перспективы использования щелочных металлов в области ядерных наук и медицины.
Использование в технологии и научных исследованиях

Щелочные металлы, такие как литий, натрий и калий, имеют множество применений в технологии и научных исследованиях.
Литий широко используется в производстве легких и прочных материалов, таких как литий-алюминиевые сплавы, которые находят применение в авиации и ракетостроении. Он также используется в производстве литиевых батарей, которые имеют высокую плотность энергии и широко применяются в портативных электронных устройствах, электромобилях и солнечных батареях.
Натрий является неотъемлемым элементом в производстве стекла, мыла и моющих средств. Он используется как реагент и катализатор в химических процессах. Натрий также используется в производстве керамики и стеклокерамики, которые обладают высокими механическими свойствами и используются в различных инженерных приложениях.
Калий широко применяется в сельском хозяйстве в качестве удобрения, так как он является важным макроэлементом для роста и развития растений. Он также используется в производстве удобрений, стекла, мыла и в производстве калийных солей, таких как калий хлористый, которые широко используются в медицине и пищевой промышленности.
Щелочные металлы также находят применение в научных исследованиях. Литий используется в ядерной физике для получения теплового энергии. Натрий и калий используются в химических исследованиях, включая синтез органических соединений и изучение реакций. Они также являются важными элементами в аналитической химии для определения содержания других элементов в образцах.
В целом, использование щелочных металлов в технологии и научных исследованиях имеет широкий спектр применений и способствует развитию различных отраслей науки и промышленности. Их уникальные свойства и химическая реактивность делают их незаменимыми элементами для множества приложений.
Вопрос-ответ

Какие свойства отличают щелочные металлы от других элементов?
Щелочные металлы обладают рядом уникальных свойств, которые делают их отличными от других элементов. Они являются мягкими и хорошо обрабатываемыми, легко реагируют с кислородом и водой, обладают низкой плотностью и температурой плавления. Кроме того, щелочные металлы обладают отличной электропроводностью и легко формируют ионы в растворах.
Какие элементы относятся к классу щелочных металлов?
К классу щелочных металлов относятся такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы находятся в первой группе периодической таблицы и имеют один электрон в валентной оболочке.
Почему щелочные металлы легко реагируют с кислородом и водой?
Щелочные металлы легко реагируют с кислородом и водой из-за своей низкой электроотрицательности и низкой ионизационной энергии. Это значит, что они готовы отдать свой внешний электрон и образовать положительный ион. При реакции с кислородом щелочные металлы образуют оксиды, а с водой - гидроксиды.
Какие применения имеют щелочные металлы в промышленности и научных исследованиях?
Щелочные металлы имеют широкое применение в промышленности и научных исследованиях. Например, литий используется в производстве легких и прочных материалов, для создания литиевых батарей и в медицине. Натрий находит применение в производстве стекла, мыла и обеззараживающих средств. Калий используется в удобрениях и в производстве взрывчатых веществ.
