Щелочные металлы – это группа элементов периодической таблицы, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают высокой реакционной способностью и сильной щелочностью. На воздухе эти металлы проявляют неустойчивость и быстро окисляются, образуя оксидные пленки, которые мешают дальнейшей реакции.
Контакт щелочных металлов с влажностью или кислородом в воздухе может привести к взрыву или пожару. Оксидные пленки, образующиеся на поверхности металла при взаимодействии с кислородом, несут в себе риск возгорания или взрыва при накоплении. Поэтому важно хранить и транспортировать эти металлы в специальных контейнерах, заполненных инертным газом, чтобы предотвратить контакт с воздухом.
Щелочные металлы широко применяются в различных областях, включая производство аккумуляторов, литий-ионных батарей, сплавов, стекла и синтеза органических соединений. Однако их химическая активность и реакционная способность требуют особого внимания и осторожности при работе с ними.
Безопасное обращение с щелочными металлами требует знания и соблюдения правил техники безопасности. При контакте с воздухом необходимо определить эффективные способы предотвращения реакции и обеспечения безопасности персонала и окружающей среды.
В целом, щелочные металлы представляют собой уникальные элементы, которые обладают множеством полезных свойств и применений. Однако их неустойчивость на воздухе требует особой осторожности при хранении и обращении с ними, чтобы не допустить опасных реакций и несчастных случаев.
Определение неустойчивости

Неустойчивость щелочных металлов на воздухе является серьезной проблемой, которая связана с их химическими свойствами. Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), имеют склонность реагировать с кислородом воздуха, образуя оксиды или пероксиды. Это приводит к образованию оксидных пленок, которые могут быть взрывоопасными и приводить к самозажиганию.
Неустойчивость щелочных металлов на воздухе обусловлена тем, что они имеют низкую энергию ионизации, что делает их очень реактивными. Когда щелочные металлы вступают в контакт с воздухом, происходит реакция с кислородом, которая приводит к образованию оксидов или пероксидов. Эти соединения образуют защитные пленки на поверхности металла, но они могут быть неустойчивыми и растворяться влагой, что способствует возникновению взрывоопасных реакций.
Неустойчивость щелочных металлов на воздухе требует специальных мер предосторожности при хранении и использовании этих металлов. Они должны храниться в сухих условиях и под контролем, чтобы предотвратить их окисление и возможное самозагорание. Кроме того, при работе с щелочными металлами необходимо использовать защитное снаряжение и соблюдать все меры безопасности, чтобы избежать возможных аварий и травм.
Воздействие влаги на щелочные металлы

Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реактивностью и неустойчивостью на воздухе. Однако, кроме воздействия кислорода и воздуха, влага также может оказывать негативное воздействие на эти металлы.
Влага приводит к образованию окислительных пленок на поверхности щелочных металлов. Эти пленки могут замедлить реакции с кислородом, но при длительном воздействии влаги они становятся причиной усиления коррозии металлов.
Когда щелочные металлы реагируют с водой, присутствующая в ней влага не только ускоряет эту реакцию, но и способствует образованию щелочных растворов. Растворение металлов в воде сопровождается выделением водорода и образованием окислительных форм металла, что может привести к образованию опасной взрывоопасной смеси.
Для предотвращения негативного воздействия влаги на щелочные металлы, их обычно хранят в герметично закрытых контейнерах, либо веществами, способными усваивать влагу. Также для металлов проводят специальные процедуры очистки и оксидации поверхности, чтобы уменьшить контакт с воздухом и влагой.
Свойства неустойчивых щелочных металлов

Неустойчивые щелочные металлы – это элементы, принадлежащие к группе 1 таблицы Менделеева, которые характеризуются высокой реактивностью и чувствительностью к воздуху. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают общими свойствами, такими как низкая плотность, высокая электропроводность и низкая температура плавления.
Одной из характерных особенностей неустойчивых щелочных металлов является их реакция с воздухом. При контакте с воздушным кислородом они немедленно окисляются и образуют оксидные пленки на поверхности. Это связано с их большой активностью и стремлением к образованию ионов положительного заряда.
Неустойчивые щелочные металлы также обладают высокой реактивностью с водой. При взаимодействии с водой они образуют водород газ и гидроксиды, которые являются сильными щелочными растворами. Такая реактивность делает их полезными в ряде промышленных процессов и в производстве соединений, таких как щелочи, сплавы и легкие металлы.
Реакция щелочных металлов с кислородом воздуха
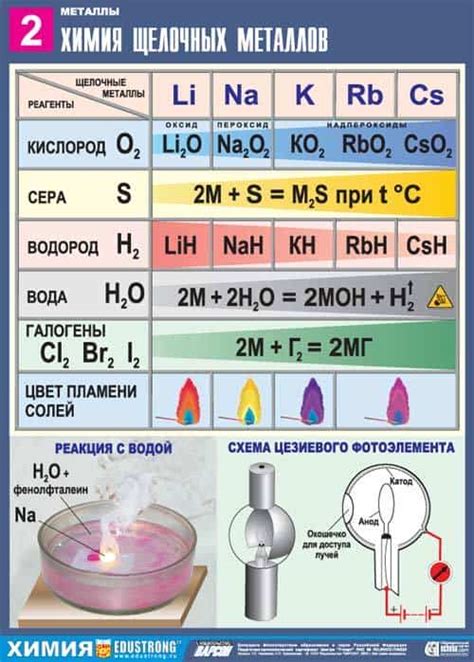
Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с кислородом воздуха, образуя оксиды и пероксиды. Это связано с тем, что щелочные металлы являются активными химическими элементами и имеют высокую электроотрицательность.
При контакте с кислородом воздуха, щелочные металлы начинают гореть, выделяя свет и тепло. Например, литий при взаимодействии с кислородом вспыхивает, образуя белый оксид лития (Li2O) или, в некоторых случаях, пероксид лития (Li2O2).
Реакция стабильности пероксидов щелочных металлов в воздухе зависит от условий окружающей среды. Например, пероксид натрия (Na2O2) может быть стабилен в сухом воздухе, но при воздействии влаги разлагается на оксид натрия (Na2O) и выделяет кислород.
Реакция щелочных металлов с кислородом воздуха имеет широкое применение в промышленности и научных исследованиях. Например, пероксиды щелочных металлов используются в качестве окислителей и промежуточных продуктов в производстве химических соединений.
Таким образом, реакция щелочных металлов с кислородом воздуха является важным химическим процессом, который позволяет получать различные оксиды и пероксиды с использованием щелочных металлов.
Практическое применение неустойчивых щелочных металлов

Неустойчивые щелочные металлы, такие как литий, натрий и калий, имеют широкое практическое применение благодаря своим уникальным свойствам. Они являются отличными проводниками электричества и тепла, а также отличными катализаторами
Одно из основных применений неустойчивых щелочных металлов - производство аккумуляторных батарей. Литий-ионные аккумуляторы, содержащие литий, обладают высокой энергоемкостью и длительным сроком службы, что делает их идеальными для использования в электронных устройствах, таких как смартфоны, ноутбуки и электромобили.
Другое практическое применение неустойчивых щелочных металлов - в производстве стекла и керамики. Натрий и калий используются в процессе стеклотворения для изменения химических и физических свойств стекла, таких как его прозрачность, прочность и теплостойкость. Кроме того, натрий имеет широкое применение в производстве мыла, моющих средств и текстильных отбеливателей.
Неустойчивые щелочные металлы также используются в производстве алюминия и его сплавов. Алюминий - важный промышленный металл, который широко применяется во многих отраслях, включая автомобилестроение, строительство и упаковку. Неустойчивые щелочные металлы играют ключевую роль в создании алюминиевых сплавов, которые обладают высокой прочностью и легкостью.
Также следует отметить, что неустойчивые щелочные металлы могут использоваться в качестве катализаторов при различных химических реакциях. Например, натрий-амид (NaNH2) используется в процессе гидрирования органических соединений в химической промышленности. Катализаторы на основе неустойчивых щелочных металлов позволяют ускорить химические реакции и увеличить их эффективность.
Вопрос-ответ

Что такое неустойчивый на воздухе щелочной металл?
Неустойчивый на воздухе щелочной металл – это металл из группы щелочных металлов, который реагирует активно с кислородом воздуха и при этом образует оксиды. Примерами неустойчивых на воздухе щелочных металлов являются натрий, калий и литий.
Почему неустойчивый на воздухе щелочной металл реагирует с кислородом воздуха?
Неустойчивый на воздухе щелочной металл реагирует с кислородом воздуха из-за своей высокой химической активности. Эти металлы имеют один валентный электрон во внешней электронной оболочке, который они стремятся отдать, чтобы достичь стабильной конфигурации. При контакте с кислородом воздуха, который имеет два электрона во внешней оболочке, происходит окисление металла.
Какие оксиды образуются при реакции неустойчивого на воздухе щелочного металла с кислородом?
При реакции неустойчивого на воздухе щелочного металла с кислородом образуются щелочные оксиды. Например, натрий образует оксид натрия (Na2O), калий образует оксид калия (K2O) и литий образует оксид лития (Li2O). Эти оксиды обладают щелочными свойствами и могут взаимодействовать с водой, образуя щелочные растворы.
