Химическая связь – это взаимодействие между атомами, ионы или молекулами, которое определяет их структуру и свойства. В металлах химическая связь имеет свои особенности. Типичной химической связью металлов является металлическая связь.
Металлическая связь – это взаимодействие между положительно заряженными ионами металла и свободно движущимися электронами. Ионы металла формируют решетку, в которой электроны свободно передвигаются. Это обуславливает уникальные физические свойства металлов, такие как высокая теплопроводность и электропроводность.
Основными факторами, определяющими металлическую связь, являются зонная теория и межатомные взаимодействия. Зонная теория объясняет, как образуются энергетические зоны для свободно движущихся электронов. Межатомные взаимодействия включают притяжение положительно заряженных ионов металла и электронов, которое создает стабильную металлическую решетку.
Йонная связь в металлах

Йонная связь в металлах - это особый тип химической связи, который образуется между металлическими и атомами другого элемента. В этом типе связи, металл с низкой электроотрицательностью отдает электроны другому атому, образуя ионы положительного и отрицательного заряда. Такие ионы привлекаются друг к другу электростатическими силами, формируя кристаллические решетки.
Особенностью йонной связи в металлах является отсутствие конкретной ориентации ионов в кристаллической решетке. Это связано с тем, что атомы металла с донорными электронами обладают свободными электронами в валентной зоне, которые эффективно перемещаются между металлическими ионами. Это обуславливает хорошую проводимость электричества и тепла у металлов.
Примером металла с йонной связью может служить натрий. Натрий имеет один электрон на внешней электронной оболочке, который он готов отдать, образуя катион Na+. В свою очередь, кислород имеет шесть электронов на внешней оболочке и готов принять один электрон, образуя анион O2-. Между катионами натрия и анионами кислорода образуется электростатическое притяжение, которое создает кристаллическую решетку натриевого оксида.
Металлическая связь в металлах

Металлическая связь представляет собой тип химической связи, присущий металлам. В основе этой связи лежит обмен электронами между атомами металла. Это приводит к образованию кристаллической решетки, в которой положительно заряженные ионы металла располагаются в ряд и образуют положительный заряд решетки, а электроны становятся свободными и перемещаются вокруг положительных ядер. Такая связь обеспечивает уникальные свойства металлов, такие как хорошая теплопроводность и электропроводность.
Металлическая связь также обуславливает формирование металлического блеска. Когда свет падает на поверхность металла, электроны, свободно перемещающиеся в металлической решетке, поглощают энергию от световых квантов и переходят на более высокий энергетический уровень. Затем они возвращаются на исходный уровень, излучая энергию в виде света. Это и объясняет блеск металлов.
В металлической связи присутствуют свободные электроны, которые придают металлам характерное поведение в силовых полях. Благодаря этим свободным электронам металлы обладают высокой электропроводностью и магнитными свойствами. Они могут проводить электрический ток без существенного сопротивления, что делает их идеальными материалами для производства проводов и других электронных устройств. Кроме того, свободные электроны ответственны за возникновение эффекта теплового расширения металлов. Под воздействием тепла, свободные электроны начинают более активно двигаться, что приводит к расширению решетки металла.
Ковалентная связь в металлах

Ковалентная связь - это один из видов химических связей, образующихся между атомами металла. В отличие от ионной связи, которая характерна для многих металлов, ковалентная связь возникает между атомами одного и того же металла, при которой электроны образуют общие электронные пары.
Ковалентная связь в металлах существует благодаря способности самых внешних электронов металла перемещаться между атомами. Эти электроны называются свободными электронами и образуют так называемое "море электронов". Они заполняют свободные места в электронных оболочках атомов и обеспечивают связь между ними.
Свободные электроны обеспечивают металлам такие свойства, как хорошая электропроводность и теплопроводность, пластичность и деформируемость. Они также отвечают за металлический блеск и способность металлов отражать свет.
Ковалентная связь в металлах является одной из основных причин, почему металлы обладают высокой твердостью и крепостью. Вместе с тем, эта связь позволяет металлам иметь низкую температуру плавления и кипения.
В целом, ковалентная связь в металлах играет важную роль в их химическом и физическом поведении, формируя особые свойства и структуру металлической решетки.
Гибридизация связей в металлах
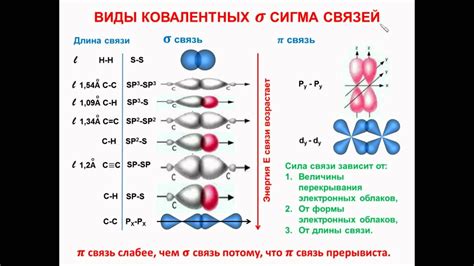
Гибридизация связей в металлах является важным физическим явлением, определяющим характер и свойства химической связи в металлических соединениях. Гибридизация связей в металлах обусловлена взаимодействием электронов, находящихся в металлической решетке, с электронами валентных оболочек атомов металла.
В результате гибридизации связей в металлах образуется так называемая металлическая связь, которая отличается от обычных ковалентной и ионной связей. Металлическая связь характеризуется высокой подвижностью электронов, что придает металлам их особые свойства, такие как проводимость электричества и тепла, пластичность и деформируемость.
Гибридизация связей в металлах может происходить различными способами, в зависимости от структуры и электронной конфигурации металла. Например, в положительно заряженных металлах, таких как натрий или алюминий, гибридизация связей происходит путем гибридизации s- и p-орбиталей. В результате образуется металлическая связь с электронами, находящимися в состоянии распределения по энергии - энергетической зоне проводимости.
В долинообразных металлах, таких как железо или кобальт, гибридизация связей происходит путем взаимодействия d-орбиталей металла с электронами валентных оболочек. Это объясняет их способность образовывать специфические связи, которые позволяют металлам образовывать сложные структуры соединений и проявлять разнообразные свойства.
Вопрос-ответ

Какие металлы имеют ионный тип химической связи?
Ионный тип химической связи характерен для металлов, которые имеют способность образовывать положительно заряженные ионы (катионы).
Какие металлы имеют ковалентный тип химической связи?
Металлы, которые имеют ковалентный тип химической связи, чаще всего находятся в нижней части периодической системы. Примеры таких металлов: алюминий, железо, магний, цинк и другие.
Какие металлы могут образовывать между собой металлическую связь?
Между собой металлическую связь могут образовывать любые металлы, так как у них есть свободные электроны, способные перемещаться в кристаллической решетке.
Почему у металлов ионный тип химической связи?
У металлов ионный тип химической связи объясняется тем, что электроны в их атомах слабо связаны и могут легко отделяться под воздействием электромагнитной силы, образуя положительно заряженные ионы - катионы.
Какой тип химической связи присутствует в сплавах?
В сплавах присутствует металлический тип химической связи, так как между металлами в них образуется кристаллическая решетка, в которой свободные электроны перемещаются между атомами.
