Неорганические соли щелочных металлов представляют собой соединения, которые включают в себя ионы щелочных металлов, таких как литий, натрий, калий, рубидий и цезий. Эти соли имеют ряд уникальных свойств и находят широкое применение в различных отраслях науки и техники.
Одно из ключевых свойств неорганических солей щелочных металлов - их высокая растворимость в воде. Благодаря этому, они легко диссоциируются на положительные катионы и отрицательные анионы, что делает их эффективными для использования в химическом синтезе и аналитической химии.
Кроме того, неорганические соли щелочных металлов обладают высокой термической и химической стабильностью, что позволяет им использоваться в высокотемпературных процессах, включая плавку и выплавку металлов, стекла и керамики. Они также используются в производстве прочных и легких материалов, таких как аллюминий и магний.
Неорганические соли щелочных металлов также находят применение в фармацевтической и пищевой промышленности. Их добавляют в препараты для регулирования уровня pH и витаминных комплексов для повышения их растворимости и усвояемости организмом. Они также используются как пищевые добавки для придания продуктам необходимого вкуса и стабильности.
Свойства неорганических солей щелочных металлов
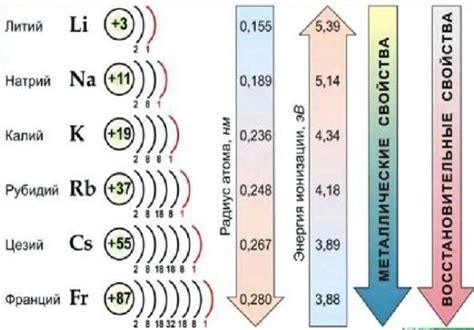
Неорганические соли щелочных металлов имеют ряд уникальных свойств, которые определяют их широкое применение в различных областях науки, техники и промышленности.
1. Растворимость: Соли щелочных металлов обычно хорошо растворяются в воде, образуя ионные растворы. Это свойство делает их идеальным выбором для использования в химических реакциях, аналитической химии и в процессах экстракции.
2. Электропроводность: Ионные растворы неорганических солей щелочных металлов обладают высокой электропроводностью из-за наличия свободно движущихся ионов. Это свойство используется в электролитических процессах, электрохимических цепях и в процессах электросинтеза.
3. Кристаллическая структура: Соли щелочных металлов образуют кристаллические структуры, которые имеют определенное пространственное упорядочение атомов. Это позволяет использовать их в качестве модельных объектов для изучения структуры и симметрии кристаллов.
4. Цветность: Некоторые неорганические соли щелочных металлов обладают цветностью благодаря присутствию ионов переходных металлов или примесей. Это свойство позволяет использовать их в процессах окрашивания стекла, керамики и в производстве красок.
5. Термическая стабильность: Соли щелочных металлов обычно обладают высокой термической стабильностью. Они не теряют своих свойств при повышенных температурах, что позволяет использовать их в высоко-температурных процессах, таких как производство стекла и керамики, а также в качестве теплоносителей в ядерной энергетике.
Это лишь некоторые из свойств неорганических солей щелочных металлов, которые делают их ценными веществами в различных областях науки и промышленности. Их уникальные характеристики продолжают исследоваться и находить новые применения в современных технологиях.
Физические свойства неорганических солей щелочных металлов

Неорганические соли щелочных металлов обладают рядом характерных физических свойств, которые определяют их поведение в различных условиях.
Первое заметное свойство - высокая степень растворимости в воде. Соли щелочных металлов образуют стабильные гидраты, что делает их хорошо растворимыми в водных растворах. Кроме того, они обладают высокой электропроводностью в водных растворах, так как ионизируются на положительно заряженные ионы металла и отрицательно заряженные ионы аниона.
Второе характерное свойство - они обычно образуют кристаллические структуры с ионной связью. Это означает, что положительные ионы металла и отрицательные ионы аниона образуют регулярную решетку в кристаллической структуре. Это обуславливает их хрупкость и высокую температуру плавления.
Третье свойство - цветовое проявление. Многие неорганические соли щелочных металлов обладают яркими цветами, такими как синий, зеленый, желтый и другие. Цветность связана с присутствием переходных металлов в кристаллической структуре, и их окислительным состоянием.
Четвертое характерное свойство - формирование двухосных кристаллов. В зависимости от условий кристаллизации, неорганические соли щелочных металлов могут формировать двухосные кристаллы, что придает им уникальную форму и внешний вид. Примером такого вещества является двухосная соль калия марганца - мурецит.
Таким образом, физические свойства неорганических солей щелочных металлов являются характерными для этой группы соединений и определяют их важные особенности при изучении и применении в различных областях науки и промышленности.
Химические свойства неорганических солей щелочных металлов
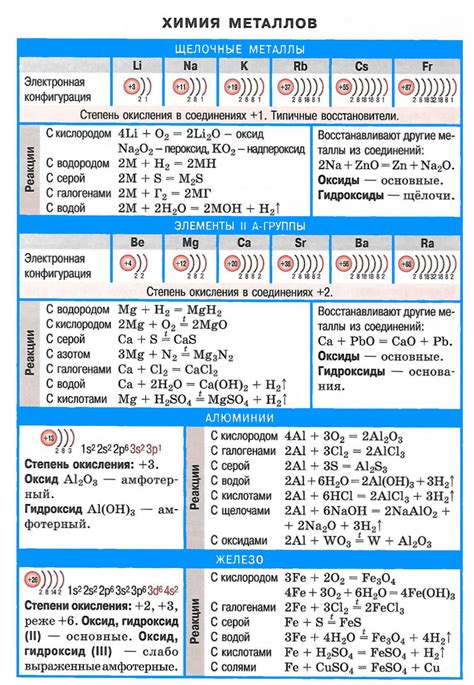
Неорганические соли щелочных металлов обладают рядом химических свойств, которые делают их важными в различных областях науки и промышленности.
Одним из основных свойств щелочных металлов является их способность образовывать соли с различными кислотами. Это свойство обусловлено способностью щелочных металлов образовывать положительные ионы, которые притягивают отрицательные ионы кислоты. В результате образуется соль, которая имеет определенные физические и химические свойства.
Еще одним важным химическим свойством неорганических солей щелочных металлов является их способность реагировать с водой. При этом происходит гидролиз, при котором соль расщепляется на ионы и образуется неорганическая кислота или щелочь. В ряде случаев гидролиз может протекать с образованием осадков или сильно изменять pH среды, что делает соли щелочных металлов важными компонентами в таких областях, как аналитическая химия и производство мыла.
Также стоит отметить, что соли щелочных металлов обладают высокой электропроводностью. Это связано с особенностями строения ионной решетки, в которой положительные и отрицательные ионы поочередно располагаются. Именно благодаря этому свойству соли щелочных металлов широко применяются в электротехнике и современной электронике.
Таким образом, химические свойства неорганических солей щелочных металлов определяют их важность и широкое применение в различных областях, таких как химическая промышленность, металлургия, медицина и другие.
Применение неорганических солей щелочных металлов
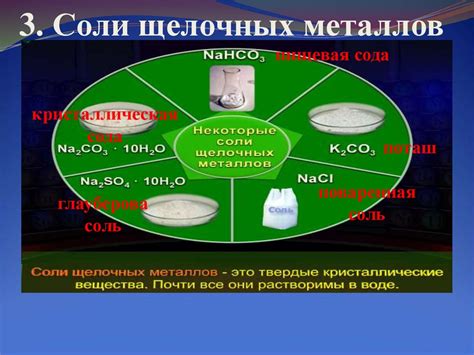
1. Производство стекла: Неорганические соли щелочных металлов, такие как калий, натрий и литий, широко используются в производстве стекла. Калий и натрий оксиды добавляются в смесь силикатов для улучшения плавления и образования стеклянной массы. Литий оксид, в свою очередь, способствует снижению температуры плавления и улучшает химическую стойкость стекла.
2. Производство щелочей: Неорганические соли щелочных металлов являются основными источниками для получения щелочей, таких как гидроксиды и карбонаты. Гидроксиды натрия и калия, получаемые из соответствующих солей, широко применяются в различных отраслях промышленности, включая производство мыла, бумаги и текстиля.
3. Использование в медицине: Некоторые неорганические соли щелочных металлов используются в медицине как лекарственные препараты. Например, сульфат магния (MgSO4) применяется для лечения судорог и гипертонических состояний. Бикарбонат натрия (NaHCO3) используется как средство для нейтрализации избыточной кислотности желудка.
4. Производство удобрений: Неорганические соли щелочных металлов часто применяются в производстве удобрений. Например, селитра натрия (NaNO3) широко используется в качестве источника азота для растений. Помимо азота, неорганические соли щелочных металлов также могут содержать другие макро- и микроэлементы, которые необходимы для роста и развития растений.
5. Применение в электронике: Некоторые неорганические соли щелочных металлов, такие как оксиды и хлориды, используются в электронной промышленности. Например, оксиды натрия и калия широко применяются в качестве диэлектриков в электролитических конденсаторах. Кроме того, неорганические соли щелочных металлов используются в процессе гальванического покрытия для создания защитных покрытий и изменения внешнего вида поверхностей.
Вопрос-ответ

Какие свойства имеют неорганические соли щелочных металлов?
Неорганические соли щелочных металлов обладают рядом основных свойств, включая высокую растворимость в воде, хорошую тепло- и электропроводность, а также образование кристаллической структуры. В солях щелочных металлов присутствует катион, образованный щелочным металлом, и анион, образованный кислотой. Каждая соль имеет свои уникальные свойства в зависимости от конкретных элементов, участвующих в ее составе.
Какие щелочные металлы входят в состав неорганических солей?
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), входят в состав неорганических солей. Они обладают высокой реактивностью и очень активными химическими свойствами. Благодаря этим свойствам они находят широкое применение в различных отраслях науки и промышленности.
Какие применения имеют неорганические соли щелочных металлов?
Неорганические соли щелочных металлов находят широкое применение в разных областях. Например, натрий и калий используются в пищевой промышленности, во фреоновых огнетушителях и в процессе стекловарения. Литий применяется в производстве аккумуляторов и керамики, а рубидий и цезий используются в научных исследованиях, в производстве лазеров и в ядерной энергетике.
Какие опасности сопряжены с использованием неорганических солей щелочных металлов?
Неорганические соли щелочных металлов могут быть опасными при неправильном использовании или при попадании в организм человека. Некоторые из них могут быть едкими или ядовитыми при прямом контакте с кожей или слизистыми оболочками. При употреблении в пищу в неправильных дозах, они также могут вызывать отравление. Поэтому при работе с неорганическими солями необходимо соблюдать меры безопасности и использовать защитное снаряжение.
