Неорганическая химия – это наука, изучающая химические элементы и соединения, не содержащие углерод. Одной из важных областей неорганической химии является изучение свойств металлов. Металлы – это элементы, обладающие хорошей тепроводностью, электропроводностью и блестящей поверхностью.
Неорганическая химия изучает различные аспекты металлов, включая их физические и химические свойства, структуру и способы получения. Важным аспектом исследования металлов является анализ их электрохимического поведения, так как они могут образовывать ионы и взаимодействовать со средой.
Изучение свойств металлов в неорганической химии имеет практическое значение. Металлы применяются в различных отраслях промышленности, включая электротехнику, автомобильную промышленность, строительство и другие. Более глубокое понимание их свойств и взаимодействий позволяет разработать новые материалы и улучшить существующие технологии.
Значение неорганической химии для изучения металлов

Неорганическая химия играет важную роль в изучении свойств металлов, которые являются основой для создания различных материалов, промышленных конструкций и разработки новых технологий.
Неорганическая химия позволяет понять основные химические свойства металлов и их реактивность. Металлы обладают уникальными свойствами, такими как хорошая электропроводность, теплопроводность и пластичность, и эти свойства определяются структурой и композицией металлической сетки. Исследования в области неорганической химии позволяют определить химическую формулу металлов, их реактивность с другими веществами, включая кислоты, основания и соли.
Свойства металлов также определяются присутствием в металлической сетке так называемых дефектов укладки и примесей. Неорганическая химия изучает взаимодействие металлов с различными сплавами, солями и анионами, а также поведение металлов в различных окружающих условиях, таких как высокая температура, высокое давление и агрессивные среды.
Неорганическая химия также играет важную роль в разработке каталитических систем, которые применяются в различных промышленных процессах. Каталитические металлы и сплавы широко используются в процессах аммиачной синтеза, производства пластиков, нефтехимической промышленности и других областях. Неорганическая химия позволяет исследовать эффективность различных каталитических систем, а также разрабатывать новые материалы с улучшенными каталитическими свойствами.
Сплошность и кристалличность металлов

Металлы являются одними из основных строительных блоков материи и обладают рядом уникальных свойств. Одно из них - сплошность, то есть отсутствие промежутков или пустот в структуре металлического материала. Кристаллическая структура металлов обеспечивает их сплошность и позволяет им обладать высокой прочностью и устойчивостью к деформации.
Кристаллическая структура металлов формируется благодаря особому расположению и взаимодействию атомов внутри материала. Атомы металла образуют упорядоченные сетки, состоящие из кристаллических зерен. Каждое зерно состоит из атомов, связанных между собой кристаллическими связями.
Кристаллическая структура металлов уникальна своей регулярностью и упорядоченностью. Она придает металлам свойства, такие как высокая электропроводность и теплопроводность, а также способность выдерживать большие нагрузки без разрушения.
Сплошность металла обеспечивает его механические свойства, такие как прочность и гибкость. Когда металл подвергается механическому воздействию, его кристаллическая структура позволяет атомам передвигаться и перераспределяться, что позволяет металлу сгибаться или деформироваться без разрушения.
Для изучения свойств металлов в неорганической химии важно учитывать их сплошность и кристалличность. Эти свойства влияют на процессы, связанные с электропроводностью, теплопроводностью и механическими характеристиками металла. Исследование кристаллической структуры и влияния различных факторов на нее позволяет лучше понять и объяснить свойства металлических материалов и использовать их в различных областях промышленности и науки.
Принципы построения кристаллической структуры металлов
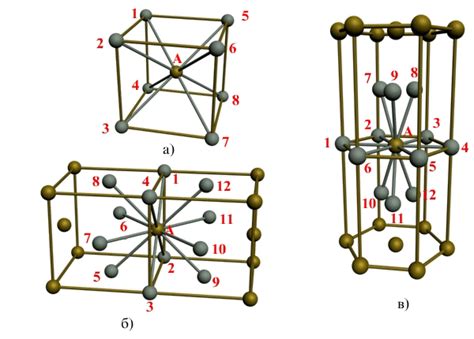
Кристаллическая структура металлов формируется в результате особой организации атомов в кристаллической решетке. Основными принципами построения кристаллической структуры металлов являются:
- Регулярное расположение атомов: Атомы металлов организованы в кристаллической решетке, при которой они занимают строго определенные позиции в пространстве. Это обеспечивает стабильность и прочность металлической структуры.
- Плотная упаковка атомов: Атомы металлов упакованы друг к другу таким образом, чтобы максимально заполнить ими пространство. В результате межатомные расстояния становятся минимальными, что обуславливает высокую плотность металлов.
- Атомные связи: Металлы обладают металлической связью, при которой электроны между атомами свободно перемещаются, способствуя электропроводности и пластичности металлов.
- Симметрия: Кристаллическая структура металлов обладает определенной симметрией, которая определяется симметрией атомов и их расположением в пространстве. Это свойство является важным для определения многих физических и химических свойств металлов.
Знание принципов построения кристаллической структуры металлов позволяет более глубоко понять и объяснить свойства металлов, а также разрабатывать новые материалы с определенными характеристиками. Изучение кристаллической структуры металлов является одним из ключевых аспектов в неорганической химии и материаловедении.
Механизмы деформации металлов

Металлы обладают высокой пластичностью и способностью к деформации. Деформация металлов может происходить по различным механизмам, в зависимости от их структуры и состава.
Один из самых распространенных механизмов деформации металлов - дислокационный. Дислокации являются дефектами кристаллической решетки металла, которые возникают из-за смещений атомов относительно своего идеального положения. При деформации металла дислокации перемещаются и аккумулируются, что приводит к пластической деформации.
Еще одним механизмом деформации металлов является структурная перестройка. При этом металл может претерпеть фазовые превращения или изменения в своей кристаллической решетке. Например, при нагревании некоторые металлы могут претерпевать мартенситное превращение и становиться более твердыми и прочными.
Также существует механизм деформации металлов через образование трещин и ползучесть. При трещинообразовании, металл разрушается по межкристаллическим границам. Например, при нагрузке на металл может происходить образование трещин из-за наличия возможных дефектов или напряжений в металлической решетке. А при ползучести, металл может деформироваться и разрушаться под воздействием длительного непрерывного нагружения.
В целом, механизмы деформации металлов являются сложными и взаимосвязанными. Изучение этих механизмов позволяет лучше понять свойства металлов и разработать новые способы их обработки и использования.
Влияние деформации на свойства металлов
Металлы являются особой группой материалов, их свойства и поведение во многом определяются их структурой и состоянием. Одним из важных факторов, влияющих на свойства металлов, является деформация.
Деформация металла может происходить как под воздействием внешних сил, так и в результате термической обработки. Одной из особенностей металлов является то, что они обладают способностью пластичной деформации. Это означает, что металлы могут легко поддаваться различным формовочным операциям, таким как ковка, прокатка и штамповка.
Деформация металла влияет на его механические свойства. При пластической деформации происходит изменение металлической структуры, что приводит к уплотнению зерен, увеличению прочности и твердости материала. Однако при этом снижается его пластичность и увеличивается ломкость. Таким образом, деформация металла может быть использована для изменения его свойств в зависимости от требуемых характеристик конечного изделия.
Одним из методов, используемых для деформации металлов, является холодная обработка. При этом металл подвергается пластической деформации при комнатной или пониженной температуре. Этот процесс позволяет повысить прочность и твердость металла, улучшить его качества механических свойств. Однако следует учитывать, что слишком большая деформация может привести к образованию трещин и разрушению материала.
Таким образом, деформация играет важную роль в изменении свойств металлов. Она позволяет создавать материалы с определенными механическими характеристиками, а также формировать сложные изделия с требуемой геометрией. При этом необходимо учитывать оптимальные параметры деформации, чтобы избежать разрушения материала и получить желаемый результат.
Электропроводность металлов

Металлы являются одними из лучших проводников электричества. Благодаря своей особой структуре, они обладают высокой электропроводностью. У металлов внешняя оболочка атомов состоит из свободных электронов, которые легко двигаются под воздействием электрического поля, перенося с собой заряд. В этом и заключается основной механизм электропроводности металлов.
Электропроводность металлов объясняется наличием электронов, свободных от связи с определенными атомами. Эти свободные электроны можно представить как облако, пронизывающее всю структуру металла и связанное с положительно заряженными ионами металла. Благодаря своей свободе, электроны могут перемещаться внутри металла, обеспечивая электропроводность.
Электропроводность металлов зависит от различных факторов, таких как концентрация свободных электронов, подвижность электронов и длина свободного пробега электронов. Хорошо проводящие металлы обладают высокой концентрацией свободных электронов и большой подвижностью электронов. Это объясняет почему металлы, такие как медь и алюминий, широко используются в электрических проводах и контактах.
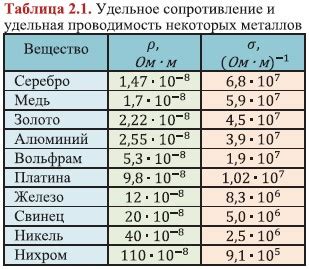
Различные металлы имеют разные степени электропроводности. Например, серебро является лучшим проводником электричества среди всех металлов, в то время как свинец и вольфрам меньше проводят электричество. Это связано с особыми свойствами структуры этих металлов и влиянием различных факторов на их электропроводность.
Внутренняя структура металлов, обусловливающая их электропроводность
Рассмотрим внутреннюю структуру металлов, которая обусловливает их высокую электропроводность. Основными компонентами структуры металлов являются кристаллическая решетка и электронное облако.
Кристаллическая решетка металлов представляет собой трехмерную упорядоченную сетку атомов, где каждый атом окружен шестью соседними атомами. Эта решетка обладает высокой степенью симметрии, что позволяет металлам образовывать крупные зерна и обеспечивает им высокую прочность.
Внутри кристаллической решетки находятся свободные электроны, которые составляют электронное облако. Это облако состоит из отрицательно заряженных электронов, которые движутся по всему объему металла свободно и независимо друг от друга. Электроны обладают низкой массой и сильно взаимодействуют со своими соседними электронами и с положительно заряженными атомами в решетке.
Именно наличие свободных электронов в металлах является основной причиной их высокой электропроводности. В результате электрического поля, наложенного на металл, свободные электроны начинают двигаться, создавая электрический ток. Благодаря свободе перемещения электронов они способны проводить электрический ток очень эффективно.
Таким образом, внутренняя структура металлов, включающая кристаллическую решетку и электронное облако, обуславливает их высокую электропроводность. Свободные электроны, находящиеся в металле, способны свободно перемещаться и создавать электрический ток под воздействием электрического поля.
Коррозия металлов

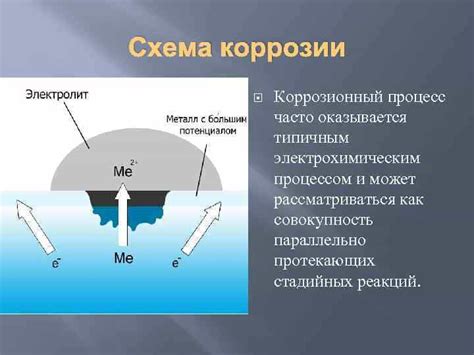
Коррозия металлов – это процесс взаимодействия металла с окружающей средой, который приводит к его разрушению и потере первоначальных свойств. В основе коррозии лежат электрохимические процессы, вызванные наличием влаги, кислорода и химически активных веществ.
Коррозия может происходить поверхностно или глубоко в структуре металла. Первичные признаки коррозии обычно проявляются в виде пятен, ржавчины или облупления поверхности металла. В процессе коррозии металла происходит образование оксидов, гидроксидов и солей, которые в дальнейшем могут вызывать дальнейшее разрушение материала.
Основными факторами, влияющими на скорость коррозии металла, являются концентрация влаги, наличие кислорода, кислоты, щелочи и солей в окружающей среде. Также важное значение имеют физические факторы, такие как температура и скорость потока влаги.
Для защиты металлов от коррозии применяются различные методы, такие как нанесение защитных покрытий (лаки, эмали, гальваническое покрытие), использование специальных антикоррозионных составов и проведение химической обработки поверхности металла.
Изучение коррозии металлов является важным направлением неорганической химии, так как позволяет разработать новые материалы и методы их защиты. Это помогает увеличить срок службы металлических конструкций, улучшить качество и надежность изделий и снизить экологический вред от выбросов коррозионных продуктов в окружающую среду.
Причины и механизмы коррозии металлов
Коррозия металлов является процессом структурного разрушения материала под влиянием окружающей среды. Данный процесс является естественной реакцией металла на окружающие условия и может привести к снижению прочности и долговечности конструкции.
Одной из основных причин коррозии является взаимодействие металла с влажностью или водой. В результате этого взаимодействия на поверхности металла происходит образование оксидов, которые являются более растворимыми, чем сам металл. В результате оксиды отслаиваются от поверхности металла, что приводит к ускоренной коррозии.
Еще одной причиной коррозии является воздействие кислот или щелочей на металл. Кислоты могут растворять оксидные пленки, образованные на поверхности металла, тем самым разрушая защитный слой и способствуя коррозии. Щелочи, в свою очередь, способны проникать в структуру металла и вызывать изменения его химического состава, что также способствует коррозии.
Механизмы коррозии металлов могут быть различными. Один из наиболее распространенных механизмов - электрохимическая коррозия. В данном случае металл становится анодом или катодом в электрохимической ячейке. При наличии влажности и кислорода происходит анодное разрушение металла, а на катоде происходит восстановление металла. Также возможна и другая форма коррозии - химическая или газообразная, которая связана с воздействием на металл газовых соединений, что приводит к образованию пузырьков или трещин на его поверхности.
Вопрос-ответ

Зачем необходимо изучение свойств металлов в неорганической химии?
Изучение свойств металлов в неорганической химии имеет большое значение для понимания и использования металлов в различных сферах деятельности. Металлы являются важными строительными материалами, используются в производстве различных продуктов, энергетике, медицине и других областях. Изучение свойств металлов позволяет определить их физические, химические и механические свойства, а также разработать новые методы обработки и использования металлов.
Какие свойства металлов изучаются в неорганической химии?
В неорганической химии изучаются различные свойства металлов, включая физические, химические и механические свойства. Физические свойства металлов включают проводимость электричества и тепла, пластичность, магнитные свойства и другие. Химические свойства металлов изучаются в реакциях с другими веществами, включая кислоты, основания, воду и другие соединения. Механические свойства металлов включают прочность, твердость, упругость и пластичность.
Какие методы используются для изучения свойств металлов в неорганической химии?
Для изучения свойств металлов в неорганической химии используются различные методы и техники. Одним из основных методов является анализ состава металлов и их соединений при помощи спектральных методов, таких как атомно-абсорбционная спектроскопия и рентгеновская флюоресцентная спектроскопия. Также используются методы структурного анализа, такие как рентгеноструктурный анализ и электронная микроскопия. Для изучения химических свойств металлов применяются методы титрования, электрохимического анализа и др.
