Периодическая система элементов – это важное средство для организации и классификации химических элементов. В ней элементы разделены на различные группы в соответствии с их химическими свойствами. Одна из наиболее важных групп элементов - это щелочные металлы, которые представляются в первой группе таблицы.
Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют общие химические свойства, такие как низкую плотность, мягкость и низкую температуру плавления. Также они обладают свойством реагировать с водой и образовывать щелочные растворы.
Однако, не все элементы первой группы таблицы являются щелочными металлами. Например, гидроген (H) и гелий (He) не входят в эту группу, несмотря на то, что они находятся в ней соответственно первым и вторым. Гидроген отличается от щелочных металлов по своим химическим свойствам и структуре атома. Гелий, в свою очередь, является инертным газом и не реагирует с другими элементами.
Щелочные металлы и их свойства

Щелочные металлы - это элементы первой группы периодической системы, которые отличаются своими химическими и физическими свойствами от других металлов. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Одним из главных свойств щелочных металлов является их низкая плотность. Благодаря этому свойству они обладают относительно низкой плотностью и легкостью, что делает их легко обрабатываемыми и подвижными. Кроме того, они обладают низкой температурой плавления и кипения.
Щелочные металлы хорошо растворяются в воде, образуя щелочные растворы. Это свойство отражено в их названии. Они обладают высокой реакционной способностью и легко вступают в химические реакции с другими веществами. Они также обладают высокой электроотрицательностью и могут образовывать ионы, и таким образом, играть важную роль в многочисленных химических реакциях.
Щелочные металлы широко используются в различных областях, включая промышленность, медицину и научные исследования. Например, калий используется в удобрениях для повышения плодородия почвы, натрий - в производстве стекла и керамики, а литий используется в производстве литий-ионных аккумуляторов, широко применяемых в электронных устройствах.
Атомный номер как определитель
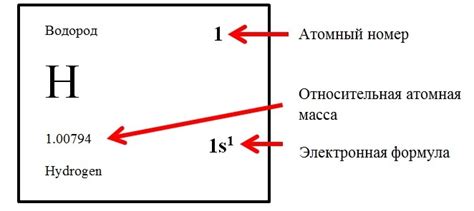
Атомный номер элемента в периодической системе является важным определителем его свойств и химической активности. Атомный номер определяет положение элемента в таблице Менделеева и указывает на количество протонов в ядре атома данного элемента.
Атомы различных элементов отличаются друг от друга числом протонов в ядре. Атомный номер, равный числу протонов, является уникальной характеристикой каждого элемента и определяет его положение в периодической системе.
Порядковый номер элемента по возрастанию атомного номера соответствует его положению в таблице Менделеева. Элементы с более низким атомным номером расположены в левой части таблицы, а элементы с более высоким атомным номером – в правой части.
Атомный номер также влияет на химические свойства элемента. В периодической системе элементы располагаются таким образом, что элементы с одинаковым числом электронов в внешней энергетической оболочке (валентные электроны) находятся в одной вертикальной группе. Группа элементов с одинаковым атомным номером имеет сходные химические свойства.
Исходя из атомного номера элемента, можно предсказать его свойства и выявить его химическую активность. Например, элементы с низким атомным номером обычно обладают металлическими свойствами, в то время как элементы с более высоким атомным номером склонны к образованию не металлических соединений.
Мягкость и низкая плотность

Щелочные металлы известны своей мягкостью и низкой плотностью. Они легко поддаются деформации и могут быть легко резаны ножом или обработаны молотом. Это связано с особенностями их кристаллической структуры.
Мягкость щелочных металлов обусловлена наличием слабых межатомных связей между ионами металла. Они обладают низкой твердостью и малой прочностью, что делает их хрупкими и легко сколыми.
Низкая плотность щелочных металлов также связана с их кристаллической структурой. Ионы щелочных металлов образуют тетраэдрическую упаковку, что приводит к большему расстоянию между ионами и, как следствие, к более низкой плотности вещества.
Низкая плотность и мягкость щелочных металлов делает их идеальными для использования в различных областях, включая производство сплавов, аккумуляторов, светофоров и других электронных устройств. Однако, из-за своей реактивности и высокой реакционности с водой и кислородом, щелочные металлы требуют специального хранения и использования.
Металлы с низкой температурой плавления

Температура плавления – это температура, при которой материал переходит из твердого состояния в жидкое. В большинстве случаев металлы имеют высокую температуру плавления, что делает их незаменимыми материалами в различных отраслях промышленности. Однако существует небольшое число металлов, которые обладают низкой температурой плавления и, следовательно, могут быть подвержены растворению или деформации при условиях обычной температуры.
Одним из таких металлов является ртуть. Ее температура плавления составляет около -39 градусов по Цельсию, что делает ртуть жидкой при комнатной температуре. Химические и физические свойства ртути делают ее важным материалом в различных отраслях, включая электронику, стеклоделание и медицинскую термометрию.
Другим металлом с низкой температурой плавления является олово. Его температура плавления составляет около 232 градусов по Цельсию. Олово широко используется в производстве различных изделий и материалов благодаря своим свойствам: высокая устойчивость к коррозии, низкая токсичность и способность легко плавиться.
Еще одним металлом с низкой температурой плавления является тулений. Его температура плавления составляет около 301 градус по Цельсию. Тюлен, который является вторым наиболее популярным металлом после олова, широко используется в промышленности благодаря своим свойствам: высокая плотность, устойчивость к коррозии и способность адсорбировать газы.
В заключение, металлы с низкой температурой плавления представляют особый интерес в промышленности и науке. Они обладают особыми свойствами и могут использоваться в различных отраслях благодаря своей специфической физической структуре и химическому составу.
Реакция с водой и воздухом

Не все металлы являются щелочными и способны реагировать с водой или воздухом. Например, металлы такие, как железо, алюминий и магний, не являются щелочными и не реагируют с водой.
Тем не менее, некоторые металлы, такие как натрий и калий, реагируют с водой, образуя гидроксид металла и выделяя водород. Эта реакция происходит потому, что щелочные металлы являются сильными восстановителями и имеют высокую активность.
Воздействие воздуха на металлы также может вызывать реакцию, но она не всегда происходит. Например, железо реагирует с кислородом воздуха, образуя ржавчину, которая является окислом железа. Алюминий также реагирует с кислородом, но образует пленку оксида, которая защищает его от дальнейшей реакции.
Важность щелочных металлов в быту

Щелочные металлы играют важную роль в нашем повседневном быту. Они находят применение в различных сферах, начиная от домашнего хозяйства и заканчивая промышленностью. Одним из самых широко используемых щелочных металлов является натрий.
Натрий, находясь в составе соли, используется в пищевой промышленности в качестве консерванта и регулятора кислотности. Он также является неотъемлемой частью многих бытовых продуктов, таких как стиральные порошки, поскольку имеет отличные моющие свойства. Благодаря натрию мы можем легко удалить пятна с одежды и сохранить их чистоту и свежесть.
Калий, еще один важный щелочной металл, широко применяется в медицине и фармацевтике. Он является необходимым элементом для нормальной работы организма: регулирует водный баланс, участвует в работе сердечно-сосудистой системы и нервной системы. Также калий используется как удобрение в сельском хозяйстве, повышая плодородие почв и увеличивая урожайность.
Литий, в свою очередь, нашел применение в промышленности и медицине. Этот металл используется для производства легких и прочных аккумуляторов, которые находят применение в электрических автомобилях и портативных устройствах. Медицина также использует литий в лекарствах для лечения психических расстройств, таких как биполярное расстройство.
Ксенон, газообразный щелочной металл, используется в осветительной технике, в частности, в различных типах ламп. Он отличается высокой светоотдачей и долгим сроком службы, что делает его идеальным для использования в автомобильных фарах и освещении дорог.
Выводящие металлы, такие как цезий и рубидий, используются в научных исследованиях и технологиях для создания точных измерительных инструментов, например, в атомных часах и спутниковой навигации. Они также находят применение в производстве инфракрасных лазеров и при создании микрочипов.
Щелочные металлы являются незаменимыми компонентами в различных сферах нашей жизни. Они обеспечивают надежность и функциональность многих бытовых и промышленных продуктов, а также имеют важное значение в научных исследованиях и разработках.
Практическое применение щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, имеют широкое практическое применение в различных отраслях науки и промышленности. Они являются неотъемлемой частью нашей повседневной жизни и используются во многих сферах деятельности.
Одним из основных применений щелочных металлов является использование лития в производстве литиевых батарей. Литиевые батареи обладают высокой энергетической плотностью, что позволяет им быть легкими и компактными, и они широко применяются в портативных устройствах, таких как мобильные телефоны, ноутбуки и электрические автомобили.
Натрий, в свою очередь, находит применение в производстве щелочных элементов для осветительных приборов. Эти элементы используются в люминесцентных лампах, галогенных лампах, а также в светодиодах, что позволяет получать яркое и эффективное освещение. Кроме того, натрий используется в производстве сплавов, удобрений и даже в пищевой и фармацевтической промышленности.
Калий имеет широкое применение в сельском хозяйстве, так как его соединения используются в качестве удобрений. Калийные удобрения обеспечивают растения необходимыми питательными веществами для их здорового роста и развития. Кроме того, калийные соединения применяются в производстве стекла, мыла, моющих средств и даже в производстве огнеупорных материалов.
Каждый из щелочных металлов находит свое особое применение в различных областях. Благодаря их уникальным свойствам и возможностям, они продолжают находить новые способы использования и способствуют развитию науки и технологий.
Токсичность щелочных металлов
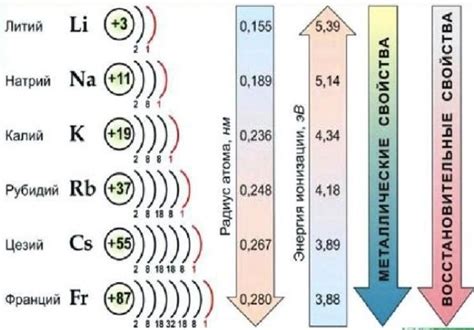
Щелочные металлы - это элементы периодической таблицы, которые относятся к первой группе: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают химическими свойствами, характерными для щелочных металлов, однако их токсичность может представлять опасность для человека.
Токсичность щелочных металлов основана на их активности и реакционной способности с другими веществами. Они могут вызывать ожоги при контакте с кожей и слизистыми оболочками. Контакт с щелочными металлами может привести к раздражению, воспалению и даже химическому ожогу.
Однако, основная опасность токсичности щелочных металлов связана с возможностью их попадания в организм человека через оральное потребление. При взаимодействии с водой, щелочные металлы образуют щелочные растворы, которые могут вызвать ожоги пищевода и желудка, а также нарушить работу других систем организма. Важно соблюдать меры предосторожности при использовании щелочных металлов в промышленности или в быту, чтобы предотвратить их попадание в организм.
Для защиты от токсичности щелочных металлов необходимо использовать специальные защитные средства, такие как перчатки, защитные очки и специальную одежду. При работе с щелочными металлами рекомендуется проветривать помещение, чтобы предотвратить накопление паров и пыли. Если возникло подозрение на отравление щелочными металлами, необходимо немедленно обратиться к врачу и принять соответствующие меры по нейтрализации вещества.
Токсичность щелочных металлов подтверждает необходимость соблюдения мер предосторожности при работе с ними. Знание химических свойств и возможных последствий контакта с щелочными металлами помогает предотвратить возникновение травм и отравлений.
Общее влияние щелочных металлов на окружающую среду

Щелочные металлы, такие как литий, натрий, калий и др., играют важную роль в множестве процессов, связанных с влиянием на окружающую среду. При этом, их влияние может быть как положительным, так и отрицательным.
Одним из положительных аспектов использования щелочных металлов в окружающей среде является их применение в сфере энергетики. Например, литий является ключевым компонентом в производстве литий-ионных аккумуляторов, которые широко используются в электромобилях, солнечных батареях и других источниках чистой энергии. Использование этих аккумуляторов позволяет снизить выбросы вредных веществ и уменьшить негативное воздействие на окружающую среду.
Однако, в то же время, неконтролируемое использование щелочных металлов может привести к негативным последствиям для окружающей среды. Например, натрий, используемый в производстве стекла и мыла, может попадать в окружающую среду в виде сточных вод и приводить к загрязнению водных ресурсов. Калий, широко применяемый в сельском хозяйстве в качестве удобрения, может вызывать эрозию почвы и загрязнение грунтовых вод.
Для минимизации отрицательного влияния щелочных металлов на окружающую среду необходимо принимать меры по контролю и утилизации отходов производства, использовать технологии переработки и восстановления щелочных металлов и осуществлять стратегическое планирование, направленное на снижение необходимости в использовании этих веществ.
Таким образом, щелочные металлы имеют значительное влияние на окружающую среду, и для поддержания экологической устойчивости необходимо сбалансированное использование и контроль их применения.
Вопрос-ответ

Какие элементы входят в класс щелочных металлов?
К классу щелочных металлов относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему не является щелочным металлом элемент симандриум?
Элемент симандриум (Sm) не является щелочным металлом, так как он относится к классу редкоземельных элементов (2-й период, 6-й группа).
Какие свойства отличают щелочные металлы от других элементов?
Щелочные металлы обладают следующими свойствами: низкой плотностью, низкой температурой плавления и кипения, мягкостью, способностью реагировать с кислородом и водой, образованием щелочных оксидов и гидроксидов.
