Натрий – это элемент химического периодического стола, который обычно относят к щелочным металлам. Его легко узнать по символу Na и атомному номеру 11. Натрий является чрезвычайно активным элементом, обладающим химической реактивностью, что делает его одним из ключевых составляющих многих химических соединений. Однако существует некоторая неточность в определении натрия как исключительно щелочного металла, поскольку он также может проявлять амфотерные свойства.
Амфотерные металлы могут реагировать с кислотами и щелочами, что означает, что они проявляют как металлическую, так и неметаллическую характеристики. В отличие от других щелочных металлов, таких как литий и калий, натрий может реагировать не только с кислотами, но и с некоторыми оксидами. Способность натрия проявлять амфотерные свойства делает его более универсальным элементом, способным взаимодействовать с разными соединениями и средами.
Однако, несмотря на это, натрий в большинстве случаев все же рассматривается как щелочной металл. Его реакции с кислотами и щелочами обычно являются более яркими и энергичными по сравнению с амфотерными металлами, такими как алюминий и цинк.
Таким образом, хотя натрий обладает амфотерными свойствами, он признается и классифицируется как щелочной металл из-за его ярких реакций с кислотами и щелочами. Его химические свойства делают его незаменимым элементом во многих отраслях промышленности и научных исследований.
Амфотерные свойства натрия
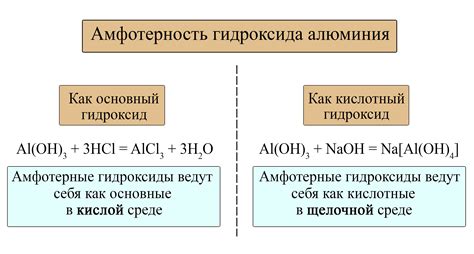
Натрий – один из основных элементов, проявляющих амфотерные свойства. Это означает, что он может проявлять кислотные и щелочные свойства в зависимости от реакции с другими веществами. В результате этого натрий может образовывать соли с кислотами и основаниями.
Когда натрий взаимодействует с кислотой, он действует как щелочной оксид. Например, при реакции с серной кислотой Na2SO4 образуется натрийсульфат. При этом натрий выступает в роли щелочи и нейтрализует кислотное свойство серной кислоты.
С другой стороны, натрий также может взаимодействовать с основанием и проявлять кислотные свойства. Например, при реакции с гидроксидом натрия NaOH образуется натриевая гидроксид. В этом случае натрий действует как кислотный оксид и реагирует с основанием, образуя соль.
Таким образом, натрий обладает амфотерными свойствами, которые позволяют ему взаимодействовать как с кислотами, так и с основаниями. Это делает натрий важным элементом во многих химических реакциях и процессах.
Реакция натрия с кислотами

Натрий является амфотерным металлом и реагирует с различными кислотами, образуя соли и выделяяся водород. При взаимодействии с сильными минеральными кислотами, такими как соляная кислота (HCl) или серная кислота (H2SO4), на поверхности натрия образуется обжигающее газовое облако хлороводорода (HCl) или сероводорода (H2S), соответственно.
Натрий также реагирует с кислотами, содержащими кислород, такими как азотная кислота (HNO3) или сернистая кислота (H2SO3). В результате этих реакций образуются соответствующие соли натрия и выделяются водород и окислы.
Интересно отметить, что никакие реакции натрия с кислотами не происходят с ацетоновой кислотой (CH3COOH) или уксусной кислотой (CH3CO2H), так как они не обладают достаточной кислотностью для образования солей и выделения водорода.
Таблица ниже показывает реакции натрия с некоторыми распространенными кислотами:
| Кислота | Реакция |
|---|---|
| Соляная кислота (HCl) | 2Na + 2HCl → 2NaCl + H2 |
| Азотная кислота (HNO3) | 3Na + HNO3 → 3NaNO3 + 1.5H2 |
| Серная кислота (H2SO4) | 2Na + H2SO4 → Na2SO4 + H2 |
| Уксусная кислота (CH3CO2H) | Нет реакции |
Таким образом, реакция натрия с кислотами зависит от их кислотности и потенциала образования солей. Натрий проявляет амфотерные свойства только в случае взаимодействия с определенными кислотами, которые могут выделять водород и образовывать с ним соли.
Взаимодействие натрия с основаниями

Натрий, как амфотерный металл, может проявлять свойства оснований при взаимодействии с кислотами. Однако его реакция с основаниями имеет свои особенности.
При взаимодействии натрия с щелочными гидроксидами образуется натриевая соль и выделяется водород. Например, соединение NaOH + H2O превращается в Na+ + OH- + H2. Таким образом, натрий может проявлять основные свойства и образовывать соли щелочных металлов.
Однако взаимодействие натрия с амфотерными оксидами и гидроксидами более сложно. Если амфотерное вещество более активно, то натрий будет проявлять свойства кислоты. Например, при взаимодействии с оксидом алюминия (Al2O3), натрий выступает в роли кислоты, образуя алюминат натрия (NaAlO2) и выделяя воду. Можно представить это в виде реакции: Na + Al2O3 + H2O -> NaAlO2 + H2.
Таким образом, взаимодействие натрия с основаниями имеет свои особенности и зависит от химического соединения, с которым оно происходит. Натрий может как проявлять свойства основания, образуя соли, так и свойства кислоты, образуя гидроксидные комплексы с амфотерными веществами.
Натрий в щелочных растворах и реакциях
Натрий - активный металл, который проявляет амфотерные свойства в реакциях с щелочными растворами. Щелочные растворы обладают высоким рН и могут гидролизировать соли, амфотерный металл, такой как натрий, может реагировать как сильное основание или слабая кислота.
Когда натрий реагирует с щелочными растворами, например, раствором натриевой гидроксида (NaOH), образуется ион натрия (Na+) и ион гидроксида (OH-). Реакция идет с выделением большого количества тепла и образованием щелочного раствора. Натриевый гидроксид является сильным основанием, поэтому натрий в данной реакции действует как сильное основание.
В то же время, натрий может проявлять свойства слабой кислоты в реакциях с некоторыми кислотными растворами. Например, в реакции с раствором серной кислоты (H2SO4), натрий образует ион натрия (Na+) и дисульфатную кислоту (NaHSO4). В данной реакции натрий выступает в роли слабой кислоты, передавая атом водорода кислороду из серной кислоты.
Таким образом, натрий проявляет амфотерные свойства в реакциях с щелочными растворами, выступая как сильное основание, а также реагирует с некоторыми кислотными растворами, выступая как слабая кислота. Эти свойства натрия важны при изучении его химических свойств и использовании в различных промышленных и научных процессах.
Натрий и амфотерные оксиды

Натрий (Na) - это химический элемент, принадлежащий к группе щелочных металлов в периодической таблице. Он характеризуется высокой активностью и химической реактивностью.
Однако нас сегодня интересует вопрос о том, является ли натрий амфотерным металлом или нет. Чтобы ответить на этот вопрос, рассмотрим концепцию амфотерности и его связь с оксидами.
Амфотерные оксиды - это оксиды, которые могут реагировать как с кислотами, так и с основаниями. Они проявляют свойства их обоих, что позволяет им взаимодействовать со средами как кислотного, так и щелочного характера.
Классическим примером амфотерного оксида является оксид алюминия (Al2O3). Он может реагировать как с кислотами, образуя соли, так и с щелочами, формируя алюминаты.
В отношении натрия, его оксид (Na2O) не обладает амфотерными свойствами. Натриевый оксид реагирует только с водой, образуя щелочную реакцию. Поэтому натрий не является амфотерным металлом.
Физические свойства натрия

Натрий - это щелочной химический элемент, который имеет атомный номер 11 и обозначается символом Na в периодической таблице. Этот металл относится к алкалинным металлам и обладает рядом интересных физических свойств.
Первое важное свойство натрия - металлический блеск. Он обладает яркой серебристо-белой окраской и выглядит блестящим, когда его поверхность свежая и чистая. Он также достаточно мягкий металл, который можно нарезать ножом без особых усилий.
Однако, натрий реагирует с воздухом. Когда натрий находится на открытом воздухе, он начинает окисляться и покрываться тонким слоем оксида натрия. Это делает металл менее блестящим и может вызвать коррозию. Чтобы предотвратить воздействие кислорода, натрий хранится в аргоновой или керосиновой среде.
Натрий очень реактивен в среде воды. Когда он погружается в воду, легкомысленно начинает бурлить и образуется натриевая гидроксид, сопровождаемая выделением водорода. Эта реакция является достаточно сильной, чтобы натрий мог использоваться для некоторых химических экспериментов или в водородных генераторах.
Температурные свойства натрия также заслуживают внимания. Температура плавления равна 97,72°C, что делает его жидким при относительно низкой температуре. Кроме того, натрий имеет относительно низкую плотность и малую теплоемкость, что делает его полезным во многих областях, включая производство батарей и других электрических устройств.
В целом, физические свойства натрия делают его одним из самых интересных металлов. Его блеск, реактивность и возможности использования при низких температурах делают его важным элементом во многих отраслях науки и промышленности.
Вопрос-ответ

Какой химический элемент является амфотерным?
Натрий является амфотерным химическим элементом.
Какие свойства натрия делают его амфотерным элементом?
Натрий обладает амфотерными свойствами благодаря способности реагировать как с кислотами, так и с основаниями. Это свойство позволяет ему взаимодействовать с различными субстанциями и выполнять разнообразные функции в организме человека.
Какую роль играет натрий в организме человека?
Натрий играет важную роль в организме человека. Он является одним из основных электролитов и необходим для поддержания баланса воды и электролитов, а также участвует в множестве биологических процессов, таких как сокращение мышц, передача нервных импульсов и регулирование кровяного давления.
Какие продукты содержат натрий?
Натрий присутствует во многих продуктах, особенно в соленых и консервированных пищевых продуктах. Он также содержится в молоке, мясе, рыбе и некоторых овощах. Однако избыток натрия в питании может привести к различным заболеваниям, поэтому важно употреблять его в умеренных количествах.
