Активация натрия представляет собой процесс, в результате которого удаляются окисленные поверхностные пленки с электродов для повышения их активности. Этот процесс является важным звеном во многих электрохимических системах и может повысить эффективность работы электролизных и аккумуляторных установок.
Один из способов активации натрия заключается в проведении электролиза водного раствора щелочи, при котором на катоде выделяется водород. В результате этого процесса натрий, находящийся на поверхности катода, реагирует с водой, образуя гидроксид натрия и освобождая молекулы водорода.
Для активации натрия важно обеспечить достаточно высокие плотности тока и поддерживать определенные условия электролита. При этом поверхностные окисленные пленки на электродах разрушаются, и на их место образуются чистые поверхности активных материалов.
Процесс активации натрия

Активация натрия - это процесс, при котором натриевый металл подвергается обработке для повышения его реактивности и способности выделять водород при взаимодействии с водой.
Одним из способов активации натрия является его смешивание с другими металлами, например, с диспрозием. При этом в результате происходит образование сплава, обладающего более высокой реактивностью, чем исходный натрий.
Другой способ активации натрия - его прокаливание в присутствии гидрида натрия (NaH), который является сильным водородным донором. В результате этого процесса часть натрийного металла преобразуется в натриевый гидрид, что позволяет его активировать для последующего выделения водорода при его взаимодействии с водой.
Водород, выделяющийся при активации натрия, является очень важным химическим веществом. Он находит широкое применение в промышленности, в процессах синтеза различных соединений и производстве энергии. Поэтому процесс активации натрия имеет большое практическое значение и активно исследуется для повышения его эффективности и экономичности.
Выделение водорода
Выделение водорода на катоде при активации натрия является процессом, при котором происходит разложение воды на составляющие ее элементы - водород и кислород. В результате этого процесса на катоде образуется газообразный водород.
Выделение водорода на катоде происходит в результате электролиза воды. Электролиз – это процесс разложения вещества под воздействием электрического тока. В данном случае, при подаче электрического тока на воду, происходит разложение молекулы воды на ионы водорода (гидроксидные ионы H-) и ионы кислорода (оксидные ионы O2-).
При передаче электрического тока через электролит, электрические заряды притягиваются к противоположно заряженным электродам – аноду и катоду. На аноде происходит окисление, а на катоде – восстановление. В случае электролиза воды, окисление происходит на аноде, где образуются ионы кислорода. А восстановление происходит на катоде, где образуется газообразный водород.
Выделение водорода на катоде при активации натрия является важным процессом, который может применяться в различных технологических процессах. Выделенный водород может быть использован в производстве различных химических веществ, в топливных элементах и водородных топливных ячейках, а также в других отраслях промышленности.
Взаимодействие натрия с водой

Натрий – химический элемент со свойствами металла из группы щелочных металлов. При контакте с водой, натрий проявляет высокую активность и образует сильно щелочную среду.
Взаимодействие натрия с водой происходит с расцеплением водной молекулы. Молекула воды атакуется ионоизированными натрийными идионами, что приводит к образованию молекулы гидроксида натрия (NaOH) и выделению водорода. Отдельные натрийные ионы реагируют с молекулами воды, образуя гидроксид и ионы водорода.
Реакция с натрием с водой является весьма интенсивной. На практике для контроля реакции используется индикатор фенолфталеин, при взаимодействии с натрием и водой индикатор становится насыщенно красным, указывая на щелочную среду.
Выделение водорода при взаимодействии натрия с водой объясняется тем, что натрий обладает большей реакционной активностью, чем водород. В результате реакции образуются ионы гидроксида натрия, которые реагируют с водой, а молекулы водорода выделяются на катоде.
Катодный процесс
Катодный процесс при выделении водорода на катоде при активации натрия является основной реакцией, происходящей в электролизе. При этом на катоде происходит восстановление ионов водорода, которые в результате присоединения электронов превращаются в атомарный водород.
В основе катодного процесса лежит возможность натрия взаимодействовать с электронами, отдаваемыми анодом, чтобы образовать натриевые ионы. Натриевые ионы затем перемещаются в электролите к катоду, где они подвергаются редукции. В процессе редукции натриевые ионы получают электроны и становятся натриевыми атомами. Натриевые атомы затем реагируют с присутствующими водными молекулами, образуя молекулы водорода.
Следует отметить, что катодный процесс является катализирующим и одновременно определяющим шагом в процессе выделения водорода на катоде при активации натрия. Важную роль в этом процессе играют факторы, такие как концентрация натрия в электролите, температура, сила тока и состав электролита. Оптимальные условия реакции на катоде обеспечивают эффективное выделение водорода и оптимизацию процесса активации натрия.
Таким образом, катодный процесс при выделении водорода на катоде при активации натрия – это важный этап электролиза, который позволяет получить молекулы водорода путем восстановления натриевых ионов. Правильная организация и контроль этого процесса являются основой для получения высокого выхода водорода и эффективной активации натрия.
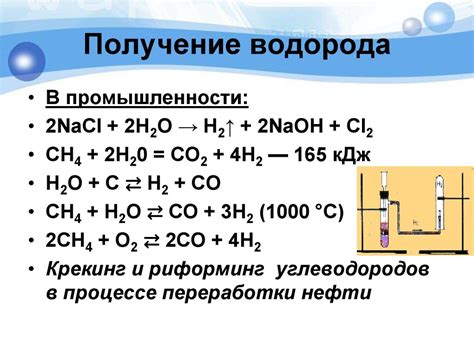
Электролиз

Электролиз - это процесс разложения вещества под действием электричества. В электролизе используются электроды, которые являются проводниками для пропуска электрического тока через реакционную среду. Один из электродов называется катодом, а другой - анодом.
При электролизе происходят окислительно-восстановительные реакции. На катоде происходит восстановление, а на аноде - окисление. На катоде образуются вещества с отрицательными зарядами, а на аноде - с положительными.
Электролиз воды является одним из наиболее распространенных видов электролиза. При электролизе воды на катоде образуется водород, а на аноде - кислород. Образующийся водород может быть использован в различных сферах деятельности, например, в производстве водородных топливных элементов или как средство хранения энергии.
Для выполнения электролиза воды, необходимо использовать электроды, которые не реагируют с веществами, содержащимися в реакционной среде. Поэтому, часто в качестве электродов применяют платину или другие ноблевые металлы.
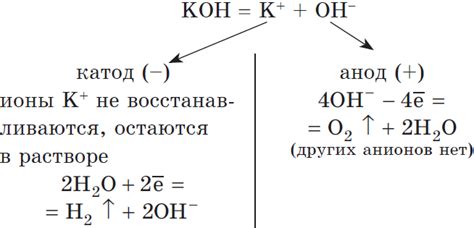
- На катоде происходит восстановление воды:
- H2O + 2e- → H2 + 2OH-
- На аноде происходит окисление воды:
- 2H2O → O2 + 4H+ + 4e-
Электролиз является важным процессом в химии и применяется в различных областях, таких как металлургия, синтез органических веществ и производство различных химических соединений.
Вопрос-ответ

Зачем нужно выделять водород на катоде при активации натрия?
Выделение водорода на катоде при активации натрия позволяет проводить реакции водорода с другими веществами для получения полезных продуктов. Водород широко применяется в промышленности для производства аммиака, металлов, водородных газов и других химических веществ. Также водород используется как топливо для водородных топливных элементов и водородных двигателей, так как при сгорании выделяется только вода, что делает его экологически чистым и эффективным источником энергии.
Как происходит процесс выделения водорода на катоде при активации натрия?
Процесс выделения водорода на катоде при активации натрия осуществляется посредством электролиза. В электролизе под действием постоянного электрического тока происходит разложение воды на водород и кислород. Катод является отрицательным электродом, на котором происходит реакция выделения водорода из ионов воды. Положительный электрод, анод, является местом окисления воды, где выделяется кислород.
Какие преимущества имеет выделение водорода на катоде при активации натрия?
Выделение водорода на катоде при активации натрия имеет несколько преимуществ. Во-первых, этот процесс осуществляется с использованием электрической энергии, что позволяет эффективно контролировать и управлять производством водорода. Во-вторых, водород является экологически чистым источником энергии, так как при его сгорании образуется только вода. В-третьих, водород имеет широкий спектр применения в промышленности, транспорте и энергетике, что делает его важным ресурсом для различных отраслей.
