Электронная конфигурация атома щелочного металла – это упорядоченное расположение электронов в энергетических уровнях атома данного элемента. Щелочные металлы в периодической системе Менделеева расположены в первой группе и включают элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов один внешний электрон, который легко отделяется, что делает их активными и реакционноспособными.
Электронная конфигурация щелочных металлов имеет общую структуру, которая соответствует электронной конфигурации атома гелия (He). На первом энергетическом уровне располагается 2 электрона, а на втором уровне – от 1 до 8 электронов. Поскольку внутренние энергетические уровни полностью заполнены, внешний электрон щелочных металлов находится в s-орбитали, что обеспечивает особую стабильность их электронной конфигурации.
Электронная конфигурация щелочных металлов можно представить в виде химической формулы, где s-орбиталь обозначается как ns1. Например, конфигурация лития состоит из двух электронов, первый из которых находится на первом энергетическом уровне (1s1), а второй электрон занимает второй энергетический уровень (2s1). Атом натрия имеет два электрона на первом энергетическом уровне (1s2) и один электрон на втором (2s1).
Что такое электронная конфигурация атома
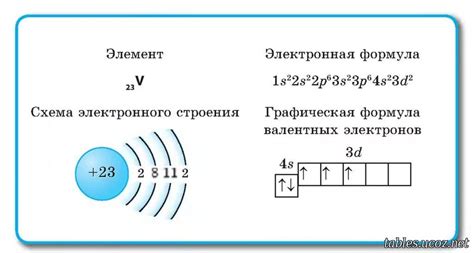
Электронная конфигурация атома – это упорядоченная информация о расположении электронов в атоме. Она описывает энергетические уровни и подуровни, на которых находятся электроны, и количество электронов на каждом уровне. Конфигурация атома определяет его химические свойства, такие как реактивность и способность образовывать химические связи.
Атом состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, в которой движутся электроны. Каждый уровень электронной оболочки включает в себя подуровни, которые обозначаются буквами s, p, d, f и имеют определенную емкость для электронов.
Для записи электронной конфигурации атома используются символы элементов и числа, обозначающие количество электронов на каждом уровне. Например, электронная конфигурация натрия (Na) равна 1s2 2s2 2p6 3s1, что означает, что в первом уровне находятся 2 электрона, во втором и третьем – по 8 и 1 электрон соответственно.
Знание электронной конфигурации атомов позволяет установить их положение в периодической системе элементов, а также понять и предсказать их химические свойства и взаимодействия с другими элементами. Это важный инструмент в химии, физике и материаловедении, который помогает разрабатывать новые искусственные материалы и процессы.
Понятие электронной конфигурации

Электронная конфигурация - это представление расположения электронов в атоме или ионе, описанное с использованием особых обозначений и правил. Она позволяет определить количество электронов в каждом энергетическом уровне атома, а также распределение электронов по орбиталям и подуровням энергетического уровня. Понимание электронной конфигурации помогает изучить различные свойства и характеристики вещества.
В электронной конфигурации атома щелочного металла, таких как литий (Li), натрий (Na) и калий (K), особую роль играют энергетические уровни s-субуровней. Все щелочные металлы имеют одну валентную электронную s-субуровню, которая вносит основной вклад в химическую активность этих элементов.
Например, атом лития имеет электронную конфигурацию 1s2 2s1, что означает наличие двух электронов на первом энергетическом уровне и одного электрона на втором энергетическом уровне в субуровне s. Атом натрия имеет электронную конфигурацию 1s2 2s2 2p6 3s1, где внешним электроном является электрон субуровня s третьего энергетического уровня.
Конфигурация электронов определяет важные свойства щелочных металлов, такие как их высокая химическая реактивность и способность образовывать ионы с положительным зарядом. Малое количество валентных электронов в энергетической субуровне s делает атомы щелочных металлов склонными отдавать эти электроны при взаимодействии с другими элементами, что определяет их активность.
Составление электронной конфигурации

Электронная конфигурация - это распределение электронов атома по его энергетическим уровням и подуровням. Она позволяет определить, сколько электронов содержится в каждом из энергетических уровней атома щелочного металла и на какие подуровни они распределены.
Составление электронной конфигурации начинается с заполнения электронами наиболее низко расположенных энергетических уровней, а затем продолжается по возрастанию энергии. При заполнении подуровней сначала заполняются все орбитали с одиночными электронами, а затем дублируются.
Для щелочных металлов, таких как литий, натрий, калий и так далее, электронная конфигурация начинается с энергетического уровня s. Например, электронная конфигурация лития - 1s2 2s1. Это означает, что первый энергетический уровень заполнен двумя электронами, а на втором энергетическом уровне находится один электрон в подуровне s.
Все щелочные металлы имеют общую особенность - наружный электрон находится на s-подуровне последнего энергетического уровня. Именно благодаря этому, щелочные металлы обладают такими химическими свойствами, как высокая реактивность и легкость ионизации.
В таблице ниже представлена электронная конфигурация щелочных металлов:
| Щелочный металл | Электронная конфигурация |
|---|---|
| Литий (Li) | 1s2 2s1 |
| Натрий (Na) | 1s2 2s2 2p6 3s1 |
| Калий (K) | 1s2 2s2 2p6 3s2 3p6 4s1 |
Таким образом, электронная конфигурация атома щелочного металла позволяет определить, сколько электронов связано с ядром и как они распределены по энергетическим уровням и подуровням. Это знание является важной основой для понимания химических свойств щелочных металлов.
Вопрос-ответ

Какова электронная конфигурация атома щелочного металла?
Атомы щелочных металлов имеют общую электронную конфигурацию ns1, где n - главное квантовое число, а s - квантовое число спина электрона.
Какой тип электронной конфигурации имеют атомы щелочных металлов?
Атомы щелочных металлов имеют "неполный" тип электронной конфигурации, где валентная оболочка содержит только один электрон, обладающий сильным желанием отдать этот электрон.
Какие элементы входят в группу щелочных металлов?
Группа щелочных металлов включает в себя следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), и франций (Fr).
Почему атомы щелочных металлов так активны?
Атомы щелочных металлов активны из-за своей электронной конфигурации, в которой валентная оболочка содержит только один электрон. Это означает, что эти элементы готовы отдать этот электрон и образовать положительный ион.
Как взаимодействуют атомы щелочных металлов с другими элементами?
Атомы щелочных металлов образуют ионные соединения с другими элементами, поскольку они готовы отдать свой валентный электрон и стать положительными ионами. Это взаимодействие приводит к образованию стабильных соединений.
