Разбавленная азотная кислота, также известная как серная азотная кислота, является сильным окислителем и взаимодействует с металлами, образуя соли и выделяя газ.
Уравнение реакции разбавленной азотной кислоты с металлом можно записать следующим образом:
M + 2 HNO3 → M(NO3)2 + H2
Где M обозначает металл, а HNO3 - азотную кислоту.
Процесс реакции сопровождается выделением водорода (H2) газа и образованием соответствующей соли металла (M(NO3)2), содержащей два аниона азотной кислоты (NO3-).
Такая реакция широко используется в химических лабораториях для выделения водорода и получения солей металлов. При этом необходимо соблюдать осторожность, так как разбавленная азотная кислота является коррозионно-опасным веществом и может причинить серьезные ожоги при контакте с кожей.
Реакция разбавленной азотной кислоты с металлом

Реакция разбавленной азотной кислоты с металлом является одной из важнейших химических реакций. Азотная кислота, также известная как серная кислота, представляет собой сильный окислитель. Взаимодействие азотной кислоты с металлами протекает по типу реакции, называемой реакцией окисления-восстановления.
В процессе реакции азотная кислота окисляет металл, при этом сама превращается в азотные оксиды. Окисленный металл образует ион металла в соответствующем оксидационном состоянии. Результатом реакции является выделение газов, обычно диоксида азота и водорода.
Реакция разбавленной азотной кислоты с металлами может протекать на разных температурах, в зависимости от концентрации и температуры кислоты, а также свойств металла. Сильно активные металлы, такие как натрий, калий и магний, реагируют с азотной кислотой довольно быстро и интенсивно.
Реакция между азотной кислотой и металлом является высокоэнергетической, сопровождается выделением тепла и яркого света. При проведении этой реакции необходимо соблюдать осторожность и избегать попадания кислоты на кожу и слизистые оболочки. Реакция может быть использована в различных химических процессах, включая производство удобрений и взрывчатых веществ.
В итоге, реакция разбавленной азотной кислоты с металлом является потенциально опасным процессом, но при правильном обращении и использовании может быть полезной в различных областях промышленности и науки.
Информация о разбавленной азотной кислоте
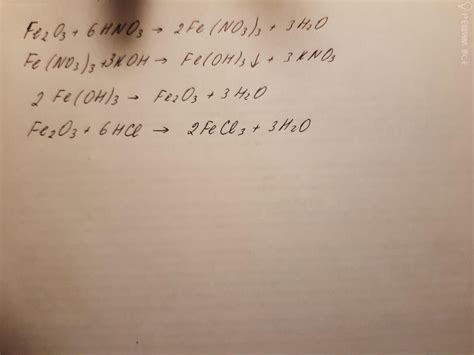
Азотная кислота (HNO₃) — бесцветная жидкость с острым запахом, является одной из наиболее распространенных неорганических кислот. Разбавленная азотная кислота обычно содержит около 70-80% HNO₃ и имеет повышенную летучесть. Она часто используется в лабораторных условиях и в промышленности для проведения различных химических реакций.
Разбавленная азотная кислота обладает сильными окислительными свойствами и может вызывать ожоги при попадании на кожу или слизистые оболочки. При взаимодействии с металлами она способна образовывать соли, аммиак и газообразные продукты.
Реакция разбавленной азотной кислоты с металлом происходит с выделением газа и образованием соответствующей соли. Например, при взаимодействии с цинком (Zn) азотная кислота окисляет металл, образуя нитрат цинка (Zn(NO₃)₂) и выделяя азотную окись (NO) в виде газа.
| Металл | Реакционное уравнение | Образованная соль | Выделяющийся газ |
|---|---|---|---|
| Цинк (Zn) | 3Zn + 8HNO₃ → 3Zn(NO₃)₂ + 4H₂O + 2NO | Нитрат цинка (Zn(NO₃)₂) | Азотная окись (NO) |
| Железо (Fe) | Fe + 6HNO₃ → Fe(NO₃)₃ + 3H₂O + 2NO | Нитрат железа(III) (Fe(NO₃)₃) | Азотная окись (NO) |
| Медь (Cu) | 3Cu + 8HNO₃ → 3Cu(NO₃)₂ + 4H₂O + 2NO | Нитрат меди(II) (Cu(NO₃)₂) | Азотная окись (NO) |
Разбавленная азотная кислота также служит исходным веществом для получения других соединений азота, используемых в промышленности и в лабораторных условиях.
Реакция разбавленной азотной кислоты с металлом

Реакция разбавленной азотной кислоты с металлом является химической реакцией, при которой происходит образование соответствующей соли и выделение водорода.
Азотная кислота (HNO3) - сильная кислота, которая при разбавлении в воде образует нитратные и гидроксидные ионы. Металлы, находясь в контакте с разбавленной азотной кислотой, протекают окислительно-восстановительную реакцию.
Протекание реакции разбавленной азотной кислоты с металлом зависит от того, находится ли металл в активном или пассивном состоянии. Активные металлы, такие как магний, цинк, железо, реагируют с азотной кислотой с выделением водорода и образованием соответствующих нитратных солей.
Реакция протекает по следующему уравнению: 2HNO3 + 3M → 3NO3M + H2, где M - металл.
Металлы, такие как алюминий и хром, не реагируют с разбавленной азотной кислотой, так как образуют защитную пленку оксида на своей поверхности и не позволяют кислоте проникнуть внутрь. Поэтому реакция с этими металлами не происходит.
Реакция разбавленной азотной кислоты с металлом является важным процессом в химической промышленности и лабораториях, используется для синтеза различных нитратных соединений и получения водорода.
Уравнение реакции

Разбавленная азотная кислота может реагировать с металлом, образуя соответствующую соль и выделяя газ. Уравнение реакции можно представить следующим образом:
2HNO3 + M → M(NO3)2 + H2
где HNO3 - азотная кислота, M - металл, M(NO3)2 - соответствующая соль, H2 - выделяющийся газ.
Данное уравнение основано на том, что азотная кислота является сильным окислителем и способна окислить металлы, освобождая молекулярный водород. Реакция протекает с выделением тепла и характеризуется быстрым химическим процессом.
Такая реакция может быть иллюстрирована путем проведения эксперимента. Для этого в реакционную колбу помещают разбавленную азотную кислоту и добавляют небольшими порциями металлический порошок. Наблюдается сильное пенообразование и выделение газа.
Уравнение реакции может быть использовано для качественного анализа, например, для определения наличия определенного металла в пробе. Если после реакции в растворе образуется осадок, это может указывать на наличие исследуемого металла.
Применение полученного продукта

Результатом реакции разбавленной азотной кислоты с металлом является образование нитратного соединения, а также выделение газа – оксида азота. Оба этих продукта имеют свои применения в различных сферах нашей жизни.
Нитратные соединения, такие как нитрат калия или нитрат аммония, широко применяются в сельском хозяйстве в качестве удобрений. Они содержат азот, который является важным питательным элементом для растений. Нитратные удобрения повышают плодородие почвы, способствуют росту и развитию растений, а также улучшают урожайность.
Оксид азота, выделяющийся при реакции, находит применение в промышленности, в основном в процессе производства азотной кислоты и аммиака. Оксид азота является важным промежуточным продуктом при синтезе этих соединений. Кроме того, оксид азота используется в качестве окислителя в реакциях взрывчатого сгорания смесей.
Также стоит отметить, что оксид азота является главным составляющим атмосферного загрязнения, которое образуется в результате сгорания топлива и промышленных процессов. Использование полученного продукта для различных целей должно быть организовано таким образом, чтобы снизить вредные последствия для окружающей среды и здоровья человека.
Вопрос-ответ

Каково уравнение реакции разбавленной азотной кислоты с металлом?
Уравнение реакции разбавленной азотной кислоты с металлом выглядит следующим образом: HNO3 + M → M(NO3)2 + H2
Какие продукты образуются при реакции разбавленной азотной кислоты с металлом?
При реакции разбавленной азотной кислоты с металлом образуются соответствующие нитраты металла и выделяется водородный газ.
Какие металлы реагируют с разбавленной азотной кислотой?
Разбавленная азотная кислота реагирует с большинством металлов, включая натрий, калий, магний, алюминий, цинк и железо. Однако некоторые металлы, такие как золото и платина, не реагируют с ней.
Какие условия реакции разбавленной азотной кислоты с металлом?
Реакция разбавленной азотной кислоты с металлом происходит при нормальных условиях температуры и давления. Однако для ускорения реакции можно нагреть смесь или использовать каталитические агенты. Также необходимо обеспечить хорошую вентиляцию, так как при реакции выделяются ядовитые газы.
Какие свойства имеет разбавленная азотная кислота?
Разбавленная азотная кислота обладает рядом химических и физических свойств. Она является сильной кислотой, хорошим окислителем, а также оказывает коррозионное действие на металлы. Она также может вызывать ожоги при контакте с кожей и может быть ядовита для организма.
