NaOH, или гидроксид натрия, является одним из наиболее распространенных химических соединений. Он широко используется в различных отраслях промышленности и научных исследованиях. Но является ли NaOH щелочным металлом? Для ответа на этот вопрос необходимо рассмотреть его химические свойства и строение.
Щелочные металлы — это элементы первой группы периодической системы, такие как литий (Li), натрий (Na), калий (K) и др. Они обладают схожими химическими свойствами, включая способность образовывать гидроксиды. Гидроксиды щелочных металлов являются сильными основаниями, которые реагируют с кислотами, образуя соль и воду. Они обладают щелочными свойствами и обычно имеют щелочную реакцию. Но NaOH в периодической системе находится в группе галогенов — седьмой группе.
Был бы странным называть NaOH щелочным металлом. Однако, химические свойства NaOH очень похожи на свойства гидроксидов щелочных металлов. Гидроксид натрия обладает сильной щелочной реакцией и используется в многих областях, где требуется взаимодействие с кислотными соединениями. Он широко применяется в промышленности, в качестве реагента в химических процессах и в бытовых условиях, как чистящее средство. Научные исследования показали, что NaOH обладает сильными щелочными свойствами и реакции с кислотами.
Таким образом, хотя NaOH не является щелочным металлом, он обладает свойствами, характерными для гидроксидов щелочных металлов. Его сильно щелочной характер делает его важным веществом в различных сферах деятельности, где требуется взаимодействие с кислотными соединениями.
NaOH и его химические свойства

NaOH (натрий гидроксид), также известный как щелочь, является одним из наиболее широко используемых химических веществ. Он представляет собой кристаллическое соединение, образующее белые гигроскопические кристаллы.
NaOH обладает сильными щелочными свойствами и широко применяется в различных отраслях промышленности. Он используется в качестве щелочи при производстве моющих средств, нейтрализатора при очистке сточных вод, а также в качестве реагента в химических лабораториях.
Одной из важных характеристик NaOH является его растворимость в воде. В нейтральной среде NaOH образует щелочную среду, обладающую высоким pH. Растворы NaOH в воде могут использоваться для нейтрализации кислот и регулирования pH различных материалов.
NaOH также является сильным окислителем. Он может реагировать с некоторыми веществами, такими как алюминий и цинк, образуя водород. Более того, NaOH может реагировать с кислородом в воздухе, образуя пероксиды натрия, что может вызывать реакцию взрывного характера.
В целом, NaOH обладает широким спектром свойств, которые делают его одним из наиболее важных и универсальных химических соединений. Его использование в различных отраслях промышленности и научных исследованиях позволяет решать множество задач, связанных с регулированием pH, очисткой и нейтрализацией различных веществ.
Состав, свойства и структура

NaOH (натриевая гидроксид, золкальная сода) является щелочным гидроксидом металла натрия. Его химическая формула состоит из одного атома натрия (Na), одного атома кислорода (O) и одной группы гидроксила (OH). Благодаря наличию гидроксильной группы, NaOH обладает щелочными свойствами и относится к классу оснований.
NaOH является твердым веществом, кристаллической структура которого представляет собой ионную решетку. В этой решетке натриевые и гидроксильные ионы чередуются и образуют устойчивую структуру. Кристаллическая форма NaOH может варьироваться в зависимости от условий синтеза и хранения.
Одно из основных свойств NaOH - его высокая щелочность. При контакте с водой NaOH диссоциирует, образуя свободные ионы натрия (Na+) и гидроксила (OH-). Эти ионы способны активно взаимодействовать с другими веществами и протекать в различных химических реакциях.
NaOH широко используется в промышленности и быту. Оно является важным компонентом для производства щелочей, мыла, стекла и бумаги. Также NaOH применяется в качестве щелочного очистителя и регулятора pH в различных процессах. Его сильные щелочные свойства также делают его опасным веществом, требующим особой осторожности при обращении с ним.
Щелочные металлы и их особенности

Щелочные металлы — это элементы, которые находятся в первой группе (IA) периодической системы химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Особенностью щелочных металлов является крайняя реактивность и химическая активность. Они хорошо растворяются в воде, образуя щелочные растворы. Натрий и калий даже реагируют с водой при обычных условиях, выделяясь горючим газом водородом. Эта реакция может быть сопровождена вспышкой или возгоранием.
У щелочных металлов низкая плотность, что позволяет им плавать на воде. На конце периода щелочные металлы становятся все более мягкими и плавкими. Например, литий — жесткий металл, подобный магнию, натрий и калий — мягкие и легко режущиеся металлы. Кроме того, щелочные металлы имеют низкую температуру плавления.
- Окислительные свойства щелочных металлов используют в различных процессах окисления
- Щелочные металлы являются важными компонентами в различных отраслях промышленности, таких как стекольная и нефтяная
- Элементы первой группы используются в синтезе органических соединений и в процессе синтеза лекарственных препаратов
Щелочные металлы также имеют высокую степень реактивности с кислородом, образуя оксиды. Литийоксид (Li2O), например, находит применение в термоядерном синтезе и в качестве абсорбента углекислого газа. Калий- и натрийоксиды широко используются в стекольной промышленности.
Таким образом, щелочные металлы обладают уникальными свойствами, делающими их важными элементами в различных областях науки и промышленности. Их химическая реактивность и активность позволяют использовать их для различных химических процессов, а также в синтезе соединений и производстве различных продуктов.
Общая характеристика и классификация
Натрий гидроксид (NaOH), также известный как щелочь, является одним из наиболее распространенных и важных щелочных металлов. Это белая кристаллическая твердая субстанция, которая часто встречается в виде полосок, гранул или кристаллического порошка.
NaOH относится к классу химических соединений, известных как гидроксиды. Гидроксиды представляют собой соединения, содержащие гидроксильную группу (OH-) в своей молекуле. Они проявляют щелочные свойства и часто используются в промышленности, науке и быту.
Обычная классификация NaOH основана на его степени чистоты. Один из наиболее распространенных вариантов натрия гидроксида - это технический натрий гидроксид. Он представляет собой неочищенную форму гидроксида, которая может содержать примеси других веществ.
Технический натрий гидроксид широко используется в различных отраслях промышленности, включая нефтегазовую, химическую и производство бумаги. Он может использоваться в качестве регулятора pH, обезжиривателя, промывки котлов, очистки и других процессов.
Растворы NaOH являются сильно щелочными и обладают высокой щелочной активностью. Из-за своей реактивности и коррозивности, они требуют осторожного обращения и хранения. Натрий гидроксид также обладает стойким запахом и может вызывать раздражение кожи и слизистых оболочек.
NaOH в реакциях

NaOH (натриевая гидроксид) проявляет свою щелочную природу во многих реакциях, которые он участвует. Это одно из самых распространенных щелочных соединений, используемых в различных отраслях промышленности и научных исследованиях.
Для начала, NaOH реагирует с кислотами, образуя соль и воду. Например, при реакции с соляной кислотой (HCl) образуется хлорид натрия (NaCl) и вода (H2O). Эта реакция является классическим примером нейтрализации кислоты и щелочи.
Кроме того, NaOH обладает сильными окислительными свойствами и может реагировать с различными веществами, включая органические соединения. Например, он может окислять алюминий, образуя алюминат натрия и выделяяся водород. Такая реакция активно используется в производстве водорода.
Еще одним интересным примером реакции с участием NaOH является гидролиз эфиров. В присутствии натриевой гидроксида эфиры, такие как этиловый, реагируют с водой, разлагаясь на спирты и натриевые соли карбоновых кислот.
В общем, NaOH активно участвует в различных химических реакциях, проявляя свою щелочную природу и обладая сложными окислительными свойствами. Это делает его важным веществом в промышленности и научных исследованиях, а также интересным объектом для изучения в образовательных целях.
Кислотно-щелочные реакции и взаимодействие с другими веществами
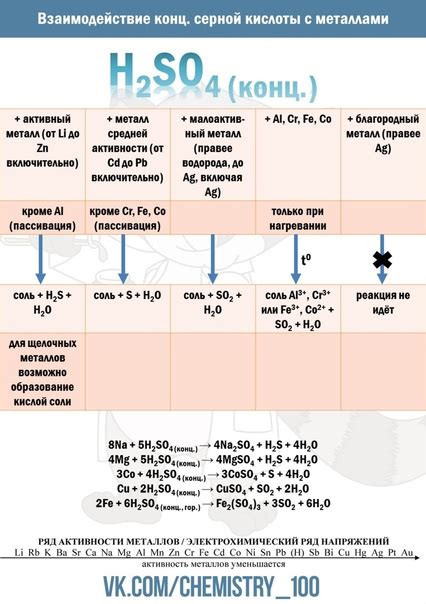
Кислотно-щелочные реакции представляют собой реакции, в которых участвуют кислоты и щелочи. Кислоты и щелочи могут вступать во взаимодействие между собой, образуя соли и воду. Например, реакция между соляной кислотой (HCl) и гидроксидом натрия (NaOH) приводит к образованию хлорида натрия (NaCl) и воды (H2O).
Взаимодействие NaOH с другими веществами также может происходить посредством образования солей и воды. Например, реакция между NaOH и серной кислотой (H2SO4) приводит к образованию сульфата натрия (Na2SO4) и воды (H2O).
Известно также, что NaOH может взаимодействовать с различными металлами. Например, реакция между NaOH и алюминием (Al) приводит к образованию гидроксида алюминия (Al(OH)3) и выделению водорода (H2). Таким образом, можно сказать, что NaOH не является щелочным металлом, а является щелочью, которая может реагировать с металлами и образовывать гидроксиды.
Взаимодействие NaOH с другими веществами подтверждается исследованиями и химическими экспериментами. При правильном использовании NaOH может быть полезным в различных областях, таких как промышленность, лабораторные исследования и бытовая химия. Однако, следует быть осторожным при работе с NaOH, так как он является щелочью и может вызывать раздражение кожи, глаз и дыхательных путей.
Научные и промышленные применения NaOH

Гидроксид натрия (NaOH) – важное химическое вещество, которое широко используется в научных и промышленных процессах. Его высокая щелочность делает его полезным ингредиентом во многих областях.
В производстве бумаги NaOH используется для обработки древесной массы, что позволяет увеличить прочность и белизну бумаги. Он также используется в процессе отбеливания текстиля и целлюлозы.
NaOH широко применяется в промышленности для очистки и обеззараживания поверхностей. Он удаляет жиры, масла и другие загрязнения, делая его идеальным для использования в моющих средствах.
Благодаря своему высокому pH, NaOH используется в металлургии для нейтрализации кислотных растворов и удаления оксидных пленок с металлических поверхностей.
Индустрия стекла также использует гидроксид натрия в процессе изготовления стекла. Он добавляется в смеси силикатов для регулировки химического состава и улучшения качества окончательного продукта.
Катализаторы на основе NaOH используются в многих реакциях, таких как эстерификация и гидрирование, для ускорения химических процессов.
Гидроксид натрия также широко используется в пищевой промышленности для регулировки pH и поддержания стабильности продуктов. Он добавляется в некоторые продукты для регулировки их кислотности или щелочности.
Сельское хозяйство также использует гидроксид натрия в качестве удобрения, особенно при возделывании почв с низким содержанием натрия.
В заключение, гидроксид натрия (NaOH) широко применяется в различных областях, включая производство бумаги, очистку поверхностей, промышленность стекла, катализаторы, пищевую промышленность и сельское хозяйство. Его высокая щелочность делает его ценным ресурсом для различных химических процессов.
Производство, очистка и использование щелочного натрия

Щелочной натрий, или натрий гидроксид, широко используется в различных отраслях промышленности. Процесс его производства основан на электролизе раствора соли. В результате этого процесса получается щелочное натриевое гидроксидное и соляное решение. Щелочной натрий служит основным продуктом процесса и представляет собой бесцветные кристаллы или пищевой растворимый порошок.
Очистка щелочного натрия включает растворение его в воде при высокой температуре и последующую перекристаллизацию. Этот процесс позволяет устранить примеси и получить чистый продукт с заданными параметрами. Полученный после очистки щелочной натрий обладает высокой концентрацией и применяется в различных отраслях промышленности, таких как производство бумаги, текстиля, стекла, мыла, моющих средств и многих других.
Помимо использования в производстве, щелочной натрий нашел применение и в бытовых целях. Он широко используется в качестве реагента при очистке и уборке. Благодаря своим щелочным свойствам, натрий гидроксид способен эффективно обезжиривать, удалять различные загрязнения и накипь. Также этот продукт может быть использован для регулирования pH-уровня в различных системах и процессах.
Щелочной натрий является важным веществом в химической промышленности и имеет широкий спектр применения. Он необходим для проведения множества химических реакций, в том числе для нейтрализации кислот, растворения жиров и очистки поверхностей. Знание основных свойств и способов использования щелочного натрия позволяет эффективно применять его в различных отраслях и сферах деятельности.
Вопрос-ответ

Чем опасен NaOH?
NaOH, или щелочной металл натрий, является опасным веществом, так как может вызывать ожоги кожи и глаз. При попадании на кожу или в глаза следует сразу же промыть большим количеством воды и обратиться к врачу.
Как использовать NaOH в быту?
В быту NaOH часто применяется для очистки и дезинфекции поверхностей, уборки труб и сантехники, а также для приготовления мыла. Однако при работе с ним необходимо соблюдать меры предосторожности и использовать защитные средства (резиновые перчатки, защитные очки).
Можно ли заменить NaOH на другие щелочные металлы?
Да, NaOH можно заменить на другие щелочные металлы, например, на калий или литий. Эти вещества имеют аналогичные свойства и применение. Однако при замене следует учитывать, что концентрация и дозировка могут отличаться.
Можно ли использовать NaOH для промывки сливных систем?
Да, NaOH можно использовать для промывки сливных систем, так как он способен растворять жировые отложения и удалить неприятные запахи. Однако при этом необходимо соблюдать меры безопасности и не допускать контакта с кожей или глазами.
