Энергия ионизации – это энергия, необходимая для удаления одного электрона из атома или иона. Она является одним из важнейших параметров, описывающих химические свойства элементов. Ионизационная энергия зависит от различных факторов, таких как размеры атома, электронная конфигурация и силы притяжения между электронами и ядром. Ионизационная энергия стремится увеличиваться по мере движения от левого к правому краю периодической системы химических элементов.
Однако, среди всех элементов в периодической системе атомов наименьшей энергией ионизации обладает атом щелочноземельного металла. Щелочноземельные металлы – это химические элементы, расположенные во второй группе периодической системы: бериллий, магний, кальций, стронций, барий и радий. Эти металлы отличаются высокой химической активностью и способностью образовывать двухвалентные ионы.
Наименьшей энергией ионизации обладает атом щелочноземельного металла бериллий. Этот элемент имеет наименьший радиус и наименьшую электронную оболочку среди всех щелочноземельных металлов, что делает его атом более стабильным и легким для удаления электрона. Это свойство придает бериллию особую активность и используется в различных областях, таких как производство сплавов, изготовление ядерных реакторов и производство огнеупорных материалов.
Энергия ионизации: что это?

Энергия ионизации – это энергия, необходимая для удаления электрона из атома или иона. То есть, это минимальная энергия, которую нужно приложить, чтобы атом или ион стал ионом более высокого заряда.
Энергия ионизации является важной характеристикой атомов и ионов, потому что она определяет их химические и физические свойства. Чем больше энергия ионизации, тем больше энергии нужно для отрыва электрона, и, соответственно, тем сложнее изменить состояние данного атома или иона.
Атомы щелочноземельных металлов, таких как гелий, литий и бериллий, обладают наименьшими значениями энергии ионизации. Это связано с тем, что у них всего один или два электрона в валентной оболочке, что делает отрыв электрона более энергетически выгодным.
Имея низкую энергию ионизации, щелочноземельные металлы легко образуют ионы положительного заряда. Это, в свою очередь, определяет их активность в химических реакциях и способность образовывать соли и соединения с другими элементами.
Щелочноземельные металлы: особенности и характеристики

Щелочноземельные металлы - это элементы второй группы периодической системы, к которым относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получили свое название благодаря своему положению в периодической системе их более легких аналогов - щелочных металлов.
Одной из основных характеристик щелочноземельных металлов является их наименьшее значение энергии ионизации среди всех элементов периодической системы. Это означает, что энергия, необходимая для отрыва одного электрона от атома щелочноземельного металла, является наименьшей среди всех других элементов. Именно поэтому щелочноземельные металлы обладают высокой реактивностью и способностью образовывать ионы положительного заряда.
Кроме того, щелочноземельные металлы имеют низкую плотность и низкую температуру плавления. Они отличаются от щелочных металлов тем, что они менее реактивны, не окисляются так легко на воздухе и не реагируют с водой так ярко и быстро, как щелочные металлы.
Щелочноземельные металлы также хорошо растворимы в воде, образуя щелочную среду. Они широко используются в различных областях, например в производстве сплавов, в производстве световых эффектов в фейерверках, а также в медицинской и сельскохозяйственной промышленности.
Атом щелочноземельного металла: что это?
Атом щелочноземельного металла – это атом элемента, принадлежащего к щелочноземельной группе периодической системы элементов. Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, находятся во второй группе таблицы Менделеева. Они обладают общими химическими свойствами, такими как высокая реактивность и способность образовывать двухвалентные ионы.
Атомы щелочноземельных металлов имеют характерные электронные конфигурации и структуру энергетических уровней. Они характеризуются наименьшим значением энергии ионизации среди всех элементов периодической системы. Энергия ионизации определяет энергию, необходимую для удаления электрона из атома. У щелочноземельных металлов эта энергия минимальна, что объясняется их электронной структурой и наличием одного электрона в валентной оболочке.
Наименьшая энергия ионизации щелочноземельных металлов делает их хорошими сырьевыми материалами для производства металлов и сплавов. Эти элементы широко используются в различных отраслях промышленности, таких как машиностроение, химическая промышленность, электроника и другие. Они также играют важную роль в биологии и медицине, где применяются в качестве кофакторов для различных ферментативных реакций и в лечении различных заболеваний.
Важность энергии ионизации атомов щелочноземельных металлов
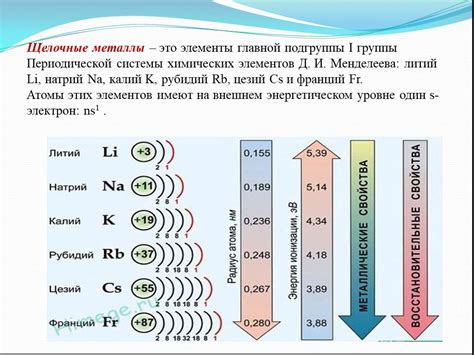
Энергия ионизации - это энергия, необходимая для отрыва электрона от атома, что приводит к образованию положительно заряженного иона. В случае щелочноземельных металлов, таких как магний, кальций или барий, энергия ионизации является наименьшей по сравнению с другими элементами периодической системы.
Это значит, что атомы щелочноземельных металлов легко отдают свои внешние электроны, образуя положительно заряженные ионы. Это особенно важно для множества процессов и систем, где необходимо иметь доступ к образованию ионов с определенным зарядом.
Наиболее очевидное применение этого свойства лежит в области химии, где щелочноземельные металлы используются в качестве реактивов для синтеза различных соединений. Использование металлов с низкой энергией ионизации позволяет получать стабильные ионы, которые участвуют в реакционных процессах.
Кроме того, энергия ионизации атомов щелочноземельных металлов имеет важное значение в области электронной техники. Эти металлы широко используются в производстве полупроводниковых устройств, таких как диоды, транзисторы и солнечные батареи. Энергия ионизации определяет, насколько эффективно металлы могут участвовать в электронном транспорте и создавать специфические электронные структуры.
Таким образом, понимание и использование энергии ионизации атомов щелочноземельных металлов является важным фактором в химической и электронной промышленности, а также в научных исследованиях. Использование металлов с низкой энергией ионизации позволяет достичь определенных химических и электронных свойств, которые могут быть ключевыми для различных приложений и технологий.
Сравнение энергии ионизации атомов щелочноземельных металлов
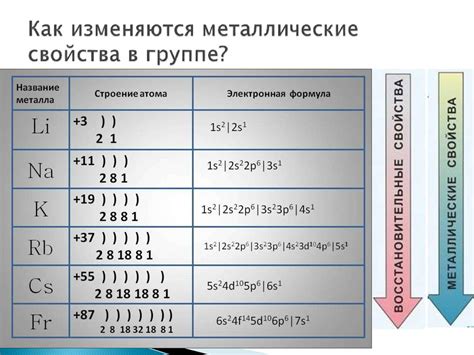
Энергия ионизации определяет энергетическую стоимость, необходимую для удаления одного электрона с атома. В случае щелочноземельных металлов, таких как бериллий, магний, кальций, стронций и барий, энергия ионизации сравнительно низкая.
Наименьшим значением энергии ионизации обладает атом щелочноземельного металла - кальция. Кальций имеет всего два электрона на внешней энергетической оболочке, что делает их отделение от атома легким процессом. Это обстоятельство обусловливает высокую реактивность кальция и способность образовывать ионы.
Следующим по убыванию энергии ионизации идет стронций, который имеет три электрона на внешней оболочке. Затем идут магний и бериллий, у которых соответственно четыре и шесть электронов на внешней энергетической оболочке.
Энергия ионизации атомов щелочноземельных металлов изменяется пропорционально заряду ядра и радиусу атома. Чем меньше радиус атома и выше заряд ядра, тем больше энергии требуется для отделения электрона от атома. Это объясняет почему энергия ионизации кальция, с меньшим радиусом и более высоким зарядом ядра, наименьшая среди щелочноземельных металлов.
Практическое применение знания об энергии ионизации щелочноземельных металлов
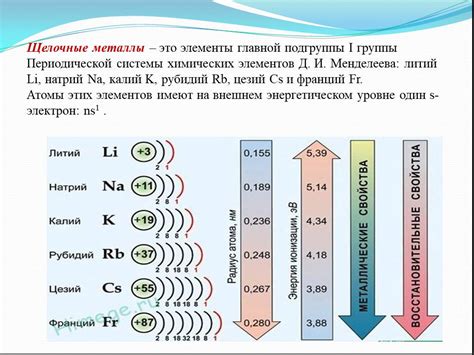
Знание об энергии ионизации щелочноземельных металлов имеет практическое применение в различных областях науки и техники. Эти металлы, такие как магний, кальций и стронций, обладают низкой энергией ионизации, что делает их особенно полезными в различных процессах и устройствах.
Одним из наиболее распространенных применений щелочноземельных металлов является их использование в производстве сплавов и легированных материалов. Их низкая энергия ионизации позволяет легко добавить их в другие металлы, улучшая их характеристики и свойства. Например, магний добавляется в алюминий для улучшения его прочности и устойчивости к коррозии.
Другим примером практического применения знания об энергии ионизации щелочноземельных металлов является их использование в различных электронных устройствах. Их низкая энергия ионизации позволяет эффективно использовать их в процессе ионизации газа в разрядных лампах и триодах. Кроме того, щелочноземельные металлы также используются в качестве катализаторов в реакциях окисления-восстановления.
Знание об энергии ионизации щелочноземельных металлов также находит применение в аналитической химии. По измерению энергии ионизации возможно определить состав и структуру различных материалов и соединений. Например, измерение энергии ионизации стронция может помочь исследователям определить его присутствие или концентрацию в образцах или растворах.
Таким образом, знание об энергии ионизации щелочноземельных металлов имеет широкий спектр применения в науке, технике и аналитической химии. Оно позволяет использовать эти металлы в различных процессах и устройствах, обеспечивая улучшение их характеристик и свойств.
Вопрос-ответ

Что такое энергия ионизации?
Энергия ионизации - это минимальная энергия, необходимая для удаления электрона из атома или иона.
Какой элемент является щелочноземельным металлом?
Щелочноземельными металлами являются элементы второй группы периодической системы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Что значит, что атом щелочноземельного металла обладает наименьшим значением энергии ионизации?
Это значит, что для удаления электрона из атома щелочноземельного металла требуется наименьшая энергия по сравнению с другими элементами. Такие атомы обладают наименьшей силой удержания электронов и, следовательно, легче ионизируются.
Какая важность у значения энергии ионизации для атома?
Значение энергии ионизации связано с характеристиками элемента, такими как его химическая активность и реакционная способность. Чем ниже значение энергии ионизации, тем легче элемент образует ионы и участвует в химических реакциях.
Какой из щелочноземельных металлов имеет наименьшую энергию ионизации?
Магний (Mg) имеет наименьшую энергию ионизации среди щелочноземельных металлов.
