Говоря о радиусе атомов щелочных металлов, можно отметить, что они обладают особыми свойствами, которые делают их уникальными в химическом мире. Щелочные металлы включают такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они находятся в первой группе периодической системы и принадлежат к самым активным элементам.
Одной из ключевых особенностей щелочных металлов является их наименьший радиус атомов по сравнению с другими элементами периодической системы. Небольшой радиус связан с особым строением электронной оболочки, а именно с наличием одного валентного электрона во внешней оболочке. Это ведет к сильному притяжению ядра атома к электронному облаку, что придает щелочным металлам высокую реакционную способность и большую склонность образовывать ионные связи.
Наименьший радиус атомов щелочных металлов имеет большое значение во многих химических и физических процессах. Это объясняется тем, что радиус атома непосредственно связан с его химической активностью и способностью вступать в реакции. Благодаря маленькому радиусу, щелочные металлы обладают большой поверхностью, что увеличивает площадь контакта между атомами и другими веществами, что способствует активному обмену электронами и передаче зарядов.
Что такое щелочные металлы?
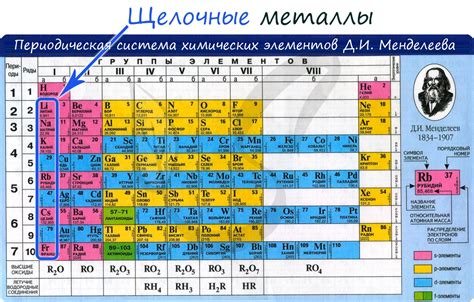
Щелочные металлы - это элементы, принадлежащие к первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются низкой плотностью, мягкостью и низкой температурой плавления. Благодаря своим физическим и химическим свойствам, щелочные металлы широко используются в различных отраслях промышленности и научных исследованиях.
Реактивность щелочных металлов обусловлена их электрохимическими свойствами. Они с легкостью окисляются воздухом и взаимодействуют с водой, образуя щелочные растворы. Щелочные металлы широко используются в процессе производства щелочей и щелочных солей, а также в качестве катализаторов в химической промышленности.
Благодаря своей низкой электроотрицательности, щелочные металлы обладают способностью образовывать ионные соединения с другими элементами. Это делает их полезными в процессе синтеза и разработке различных материалов, включая керамику, стекло и полупроводники.
Одним из основных свойств щелочных металлов является их наименьший радиус атомов. За счет этого, они способны образовывать стабильные ионные соединения, а также проявлять высокую проводимость электричества и тепла. Кроме того, щелочные металлы часто используются в качестве активных элементов в батареях и аккумуляторах, благодаря своей способности эффективно перемещать заряды через электролиты.
Определение и свойства

Наименьший радиус атомов щелочных металлов - это физическая характеристика щелочного металла, которая отражает его размер в кристаллической решетке. Радиус атома является одним из основных параметров, используемых для определения структуры и свойств вещества. Размер атома влияет на его валентность, активность и химические свойства.
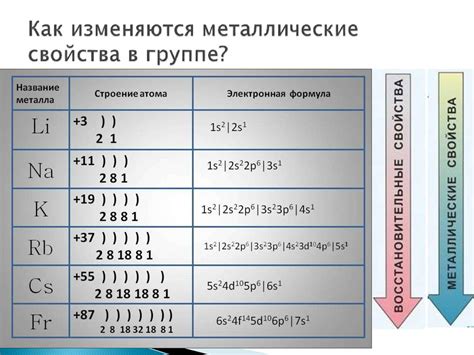
У щелочных металлов, включая литий, натрий, калий, рубидий и цезий, наименьший радиус атомов характеризуется их электронной структурой. Эти элементы имеют одну валентную электронную оболочку с одним внешним электроном, что делает их химически очень реактивными. Наименьший радиус атома щелочных металлов обусловлен большим зарядом ядра и малым количеством электронов в валентной оболочке.
Из-за своего маленького размера, атомы щелочных металлов легко ионизируются, то есть теряют внешний электрон и образуют положительные ионы. Это обуславливает их высокую реактивность и способность образовывать сильные щелочные растворы в воде. Также наименьший радиус атомов щелочных металлов определяет их способность образовывать сложные соединения с другими элементами. Например, калий может образовывать соли с различными кислотами и органическими соединениями.
Значение определения наименьшего радиуса атомов щелочных металлов состоит в понимании их химической активности и возможности использования в различных промышленных и научных процессах. Кроме того, знание наименьшего радиуса атомов позволяет прогнозировать их химические свойства и их способность взаимодействовать с другими веществами.
Наименьший радиус атомов щелочных металлов
Радиус атома – это расстояние от ядра атома до его внешней электронной оболочки. У щелочных металлов, таких как литий, натрий, калий и др., наименьший радиус атома имеет самый первый элемент периодической таблицы – литий (Li).
Наименьший радиус атомов щелочных металлов связан с их электронной конфигурацией. У атомов щелочных металлов внешний электрон находится в s-орбитали, что обуславливает эффективный экранировочный эффект другими электронами внутренних оболочек. Поэтому атомы щелочных металлов имеют меньший радиус по сравнению с атомами других элементов в периодической таблице.
Наименьший радиус атома лития (Li) составляет около 152 пикометра (1 пикометр = 10^-12 метра). Это объясняет его небольшие размеры и способность легко образовывать ионные соединения с другими элементами, так как ионы лития могут эффективно охватываться атомами других элементов.
Значение наименьшего радиуса атомов щелочных металлов имеет важное значение в химии и материаловедении. Оно определяет свойства этих металлов, такие как реакционная способность, способность образовывать соединения, проводимость электричества и тепла. Благодаря своим уникальным свойствам, щелочные металлы находят широкое применение в различных отраслях, включая энергетику, медицину, химическую промышленность и многие другие.
Зависимость от атомного номера
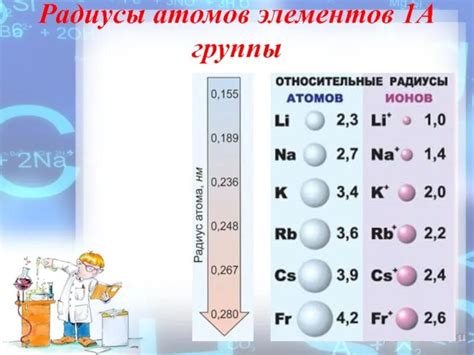
Наименьший радиус атомов щелочных металлов имеет тесную связь с их атомным номером в периодической таблице. По мере увеличения атомного номера, от лития (Li) до франция (Fr), радиусы атомов щелочных металлов постепенно увеличиваются. Это происходит из-за того, что с увеличением атомного номера, количество электронов и протонов в атоме также увеличивается.
Электроны, находящиеся во внешней оболочке атома, создают электронные облака, которые определяют радиус атома. При увеличении атомного номера, количество электронов во внешней оболочке щелочных металлов увеличивается, что приводит к расширению электронных облаков и увеличению радиуса атома.
Таким образом, наименьший радиус наблюдается у щелочных металлов с наименьшим атомным номером, таких как литий и натрий. При увеличении атомного номера, радиусы атомов щелочных металлов увеличиваются, что связано с увеличением количества электронов во внешней оболочке и расширением электронных облаков.
Особенности электронной конфигурации

Особенности электронной конфигурации щелочных металлов играют важнейшую роль в определении их физических и химических свойств. Щелочные металлы отличаются от других элементов в периодической таблице своей электронной структурой.
Первым атомом щелочного металла в периоде является литий с электронной конфигурацией 1s2 2s1. Это означает, что у лития есть два электрона в первом энергетическом уровне и один электрон во втором уровне. Подобным образом, натрий имеет электронную конфигурацию 1s2 2s2 2p6 3s1, калий - 1s2 2s2 2p6 3s2 3p6 4s1. И так далее для остальных щелочных металлов.
Особенностью электронной конфигурации щелочных металлов является наличие одного электрона в внешней оболочке, то есть в последнем энергетическом уровне.
Этот электрон, называемый валентным электроном, отвечает за химическую активность щелочных металлов. Валентный электрон легко участвует во взаимодействиях с другими атомами, что обуславливает высокую реактивность щелочных металлов.
Также стоит отметить, что уровни энергии внешних электронов в атомах щелочных металлов относительно близки к ядру, что приводит к увеличению эффективности экранирования электронов внутренних оболочек. Это объясняет особую стабильность и слабое мышление валентных электронов щелочных металлов.
Значение наименьшего радиуса атомов щелочных металлов
Наименьший радиус атомов щелочных металлов является одной из особенностей, определяющих их химические свойства. Радиус атома щелочного металла, таких как литий (Li), натрий (Na), калий (K) и других, зависит от количества электронов во внешней оболочке. Все щелочные металлы имеют один внешний электрон, поэтому их атомы имеют сферическую форму в связи с противодействием электростатическому отталкиванию электронов. Величина наименьшего радиуса атомов щелочных металлов определяется физическими закономерностями и объясняет некоторые свойства этих элементов.
Значение наименьшего радиуса атомов щелочных металлов составляет около 150 пикометров. Маленький размер атомов щелочных металлов объясняет их высокую реакционную активность. Электроны во внешней оболочке находятся на большом расстоянии от ядра, что создает электронно-ядерную привлекательную силу, способствующую реакции с другими веществами. Благодаря этому свойству, щелочные металлы реагируют с водой, кислородом, хлором и другими элементами, что делает их ценными и широко используемыми в различных областях науки и техники.
Также наименьший радиус атомов щелочных металлов имеет значение при их взаимодействии с другими элементами в соединениях. При образовании ионов, атомы щелочных металлов могут отдать свой внешний электрон, образуя ион с положительным зарядом. Большой размер ионов щелочных металлов по сравнению с ионами других элементов определяет их способность к образованию солей и катионов, что находит применение в производстве стекла, мыла и других химических процессах.
Электроотрицательность и химическая активность
Электроотрицательность является важной характеристикой атомов щелочных металлов. Она определяет способность атома притягивать электроны во время химических реакций. Из всех щелочных металлов, франций обладает наиболее низкой электроотрицательностью, в то время как литий имеет наиболее высокую электроотрицательность.
Из-за низкой электроотрицательности, атомы щелочных металлов обычно готовы отдавать свои электроны другим атомам, что делает их химически активными. В результате этого происходят различные химические реакции, включая образование ионы, сплавление и растворение во многих растворителях. Атомы щелочных металлов также способны образовывать ионные связи с атомами других элементов, что делает их незаменимыми в многих химических процессах.
Кроме того, электроотрицательность и химическая активность щелочных металлов имеют важное значение для их взаимодействия с водой. Атомы щелочных металлов горят взрывоопасно при контакте с водой из-за быстрого образования водорода и выделения большого количества энергии.
В целом, электроотрицательность и химическая активность атомов щелочных металлов обуславливают их важное место в химических реакциях и приложениях. Их способность образовывать ионные связи, растворяться в растворителях и взаимодействовать с водой делает их полезными во многих сферах, включая химическую промышленность, энергетику и медицину.
Реакция с водой

Радиус атомов щелочных металлов, таких как литий, натрий и калий, является наименьшим среди всех химических элементов. Это связано с их расположением в периодической системе и особенностями строения электронной оболочки.
Именно из-за своего малого размера и высокой реактивности, щелочные металлы обладают возможностью вступать в реакцию с водой. При этом происходит сильное образование гидроксида металла и выделение водорода. Реакция с водой является одним из основных способов демонстрации и исследования химических свойств щелочных металлов.
Реакция начинается с погружения металла в воду, при этом наблюдается выделение пузырьков газа и изменение цвета раствора. В результате реакции образуется гидроксид металла, который при наличии избытка воды немедленно диссоциирует на ионы металла и гидроксидные ионы. Возвращаясь к особенностям радиуса атома щелочного металла, можно сказать, что малый радиус позволяет легко проникать вглубь молекулы воды, сталкиваясь с ее молекулярными соединениями.
Реакция с водой является характерной внешней проявлением особенностей щелочных металлов и имеет важное значение для их применения в различных областях. Способность щелочных металлов реагировать с водой используется в производстве взрывчатых веществ, производстве электричества (в гальванических элементах), а также в других химических и технических процессах.
Вопрос-ответ

Что такое радиус атомов щелочных металлов?
Радиус атома щелочного металла - это расстояние от ядра атома до его внешней электронной оболочки. Он характеризует размер атома и его возможность взаимодействовать с другими атомами и молекулами.
Какие особенности имеет наименьший радиус атомов щелочных металлов?
Наименьший радиус атомов щелочных металлов обусловлен их электронной конфигурацией. У щелочных металлов только одна электронная оболочка, содержащая всего один электрон. Это приводит к тому, что наименьший размер имеют атомы лития и натрия.
Какое значение имеет наименьший радиус атомов щелочных металлов?
Наименьший радиус атомов щелочных металлов играет важную роль в их химических свойствах. Из-за малого размера атомов лития и натрия, они легко образуют ионные связи с другими элементами, а также образуют структуры с компактной упаковкой, что обусловливает их физические свойства и использование на практике.
