Атомный радиус - это физическая характеристика, показывающая расстояние от ядра атома до его наиболее удаленной электронной оболочки. Он важен для определения свойств и взаимодействия атомов. В различных химических элементах атомный радиус может различаться.
Щелочные металлы относятся к первой группе периодической системы элементов. Это включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают уникальными химическими свойствами, такими как низкая плотность, низкая температура плавления и активность в химических реакциях.
Наибольший атомный радиус среди щелочных металлов имеет франций. У франция атомный радиус достигает 260 пикометра. Это связано с тем, что в орбитали внешней электронной оболочки атома франция находится всего один электрон, что обусловливает большое пространство, занимаемое этим электроном.
Определение атомного радиуса

Атомный радиус - это физическая характеристика атома, определяющая его размер. Он обозначается символом "r" и измеряется в ангстремах (Å) или пикометрах (pm).
Определение атомного радиуса основано на измерении расстояния между атомами в кристаллической решетке вещества. Для этого проводятся различные эксперименты, такие как рентгеноструктурный анализ, сканирующая туннельная микроскопия и другие методы.
Атомный радиус зависит от ядерного заряда и электронной оболочки атома. Чем больше заряд ядра и количество электронов, тем больше атомный радиус. Следовательно, атомы с большим атомным номером имеют больший радиус.
Щелочные металлы, такие как литий, натрий, калий, рубидий, цезий и франций, имеют наибольший атомный радиус среди всех элементов. Это связано с тем, что они находятся в первой группе периодической системы, где электронная оболочка состоит из одного электрона в валентной области.
Имея наибольший атомный радиус, щелочные металлы обладают свойствами, такими как мягкость, низкая плотность и хорошая проводимость электричества. Эти свойства делают их важными элементами для различных приложений, включая производство батарей, легирование металлов и использование в химической промышленности.
Что такое атомный радиус
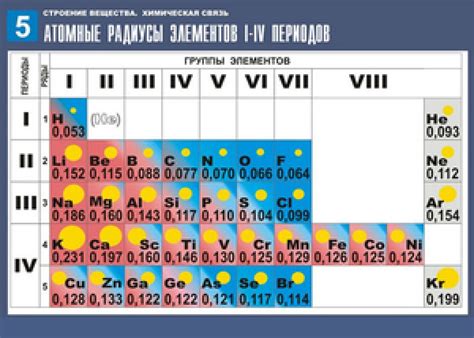
Атомный радиус - это величина, которая определяет размер атома. Он измеряется в пикометрах (1 пикометр равен 10 в минус 12 метра). Атомный радиус определяется расстоянием от ядра атома до его внешней электронной оболочки.
Атомный радиус имеет важное значение при изучении свойств различных элементов, так как он влияет на химическую активность атомов и взаимодействие между ними. Чем больше атомный радиус, тем большие атомы могут образовывать более слабые связи с другими атомами.
Атомный радиус может варьироваться в зависимости от возрастающего порядкового номера элемента в периодической системе. Обычно атомный радиус увеличивается по мере перемещения вниз по группе и уменьшается по мере перемещения вправо по периоду.
Атомный радиус имеет важное значение при изучении свойств щелочных металлов. Щелочные металлы, такие как литий, натрий и калий, имеют наибольший атомный радиус среди всех элементов в своих периодах. Их атомы имеют наружную электронную оболочку, состоящую из одного электрона, что делает их химически активными и склонными образовывать ионные соединения с другими элементами. Большой атомный радиус щелочных металлов предполагает наличие слабой связи между атомом и его внешним электроном, что способствует их реактивности и реакционной способности.
Щелочные металлы
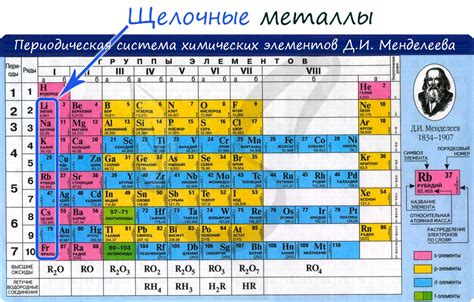
Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов и характеризуются своей реактивностью и низкой плотностью.
Все щелочные металлы обладают высокой химической реактивностью и способностью быстро соединяться с другими элементами, особенно с галогенами. Они образуют ионы с положительным зарядом, что делает их легко растворимыми в воде и обладающими хорошей электропроводностью.
У щелочных металлов есть общая особенность - наибольший атомный радиус среди всех элементов периодической таблицы. Это объясняется их большими электронными оболочками и низкими энергиями ионизации. Именно из-за этого у щелочных металлов сравнительно низкая температура плавления и кипения, а также мягкость и низкая плотность.
Щелочные металлы находят широкое применение в различных областях. Например, литий используется в производстве легких аккумуляторов и лекарствах, а натрий применяется в химической промышленности и пищевой промышленности. Калий, в свою очередь, является необходимым макроэлементом для растений и используется в сельском хозяйстве.
Итак, щелочные металлы обладают высокой реактивностью, наибольшим атомным радиусом и широким спектром применения. Знание их химических свойств является важным для понимания и исследования различных химических процессов в природе и промышленности.
Определение щелочных металлов

Щелочные металлы - это группа химических элементов, включающая в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы химических элементов и имеют наиболее низкую ионизационную энергию среди всех элементов. Щелочные металлы характеризуются высокой химической реактивностью и металлическими свойствами.
Основные характеристики щелочных металлов - это мягкость, низкая плотность и низкая температура плавления и кипения. Они обладают металлическим блеском и хорошей проводимостью электричества. Щелочные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Они также образуют сольные связи с более электроотрицательными элементами.
Щелочные металлы широко используются в различных областях, включая производство щелочных батарей, металлургию, обработку стекла, фармацевтику и многие другие. Они также применяются в качестве катализаторов в различных химических реакциях. Из-за своей реактивности щелочные металлы обычно хранят в солевых растворах или в аргонной среде, чтобы избежать контакта с влагой и воздухом.
Наибольший атомный радиус у щелочных металлов наблюдается у франция, что обусловлено его расположением в самом нижнем периоде периодической системы.
Атомный радиус в химии

Атомный радиус - это физическая величина, характеризующая размер атома. В химии атомный радиус является важным параметром, который влияет на химические свойства и реактивность атома.
Атомный радиус зависит от таких факторов, как число электронных оболочек, заряд ядра и электронная конфигурация атома. Чем больше атомный радиус, тем больше пространства занимает атом и тем более доступными становятся его электроны для взаимодействия с другими атомами.
В периодической системе элементов атомные радиусы обратно пропорциональны номеру атома в периоде. Так, внутри одного периода атомный радиус постепенно уменьшается от левого к правому краю периода. Наибольший атомный радиус имеют щелочные металлы, такие как литий, натрий, калий и другие.
Атомный радиус имеет важное значение при формировании межатомных связей. Чем больше атомный радиус, тем слабее связь между атомами. Это объясняет, почему щелочные металлы хорошо реагируют с другими веществами и образуют ионо-кавалентные соединения.
Размер атома также влияет на плотность вещества. Чем больше атомный радиус, тем меньше плотность вещества, так как атомы занимают большую часть пространства.
В заключение, атомный радиус в химии играет важную роль при изучении химических свойств и реакций атомов. Размер атома влияет на химическую активность и возможность образования связей с другими атомами. Щелочные металлы с наибольшим атомным радиусом имеют особенности в своих химических свойствах и широко применяются в различных областях науки и техники.
Области применения атомного радиуса в химии

Атомный радиус является одним из важных параметров, определяющих химические свойства элементов. В связи с этим, он находит применение в различных областях химии.
Одной из таких областей является определение валентности элементов. Валентность определяется по количеству электронов во внешнем энергетическом уровне атома. Больший атомный радиус увеличивает вероятность образования ковалентных связей, так как электроны охотнее делятся с более удаленными ядрами. Таким образом, атомный радиус позволяет определить степень окисления атома и его валентность.
Другой областью, где применяется атомный радиус, является предсказание химической активности элементов. С ростом атомного радиуса увеличивается размер атома, что позволяет электронам находиться на большей удаленности от ядерного заряда. Это способствует снижению энергии связи между электронами и ядром, что делает атом более активным химически. Например, щелочные металлы с наибольшим атомным радиусом (литий, натрий, калий) легко реагируют с водой и воздухом.
Также атомный радиус используется для проведения качественных анализов, особенно для идентификации элементов в неорганических соединениях. По размеру атомных радиусов можно предсказать, какие атомы сформируют стабильные соединения, а какие нет. Например, атомы с малым радиусом (фтор, кислород) формируют стабильные соединения с атомами большего радиуса (литий, натрий), в то время как атомы с большим радиусом не могут образовывать стабильные соединения с атомами меньшего радиуса.
Таким образом, атомный радиус является важным параметром, используемым в химии для определения химических свойств элементов, валентности, химической активности и проведения качественных анализов неорганических соединений.
Сравнение атомных радиусов щелочных металлов
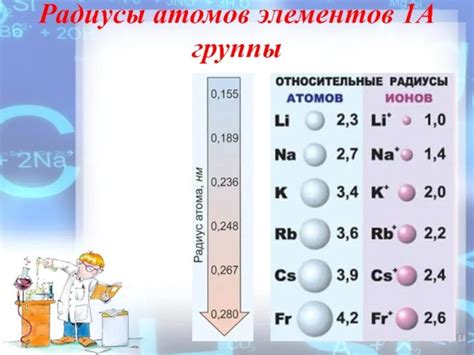
Атомный радиус является одним из основных параметров для характеризации химических элементов. Он определяет размер атома и влияет на его химические свойства. При сравнении атомных радиусов щелочных металлов видно, что они имеют увеличивающуюся тенденцию от лития до цезия.
Наименьший атомный радиус имеет литий, так как он имеет самое маленькое количество электронных оболочек. Затем идут натрий, калий, рубидий и заканчивается на цезии с наибольшим атомным радиусом.
Увеличение атомного радиуса связано с постепенным увеличением количества электронов и электронных оболочек, что в свою очередь приводит к увеличению размера атома. Это объясняется тем, что с каждым новым электроном добавляется новый электронный слой, что приводит к увеличению размера атома в трехмерном пространстве.
Таким образом, сравнение атомных радиусов щелочных металлов позволяет установить, что цезий имеет наибольший атомный радиус среди всех щелочных металлов, а литий - наименьший. Это связано с увеличением количества электронов и электронных оболочек от лития до цезия.
Границы атомных радиусов щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и другие, характеризуются наибольшими атомными радиусами среди всех элементов периодической таблицы. Атомный радиус щелочных металлов является одним из ключевых показателей их химических свойств и взаимодействий.
Литий, наименьший из всех щелочных металлов, имеет атомный радиус порядка 152 пикометра (пм), тогда как радиус цезия, самого большого из щелочных металлов, составляет около 265 пм. Таким образом, границы атомных радиусов щелочных металлов варьируются в диапазоне от 152 пм до 265 пм.
Имея такие большие атомные радиусы, щелочные металлы обладают высокой реактивностью и способностью образовывать ионы с положительным зарядом. Их атомы легко отдают свой внешний электрон, что обуславливает их способность быть хорошими восстановителями и химическими реагентами. Более того, большие атомные радиусы щелочных металлов делают их атомы более подвижными и способными к образованию связей с другими атомами.
Границы атомных радиусов щелочных металлов отражаются и в их физических свойствах. Благодаря большим атомным радиусам, щелочные металлы обладают низкой плотностью и низкими плавящими и кипящими точками. Они также хорошо проводят тепло и электричество, что делает их полезными материалами в различных промышленных и научных областях.
Таким образом, границы атомных радиусов щелочных металлов играют важную роль в определении их химических и физических свойств, и делают их особенно интересными для изучения и применения в различных областях науки и промышленности.
Разрывы между атомными радиусами щелочных металлов

Щелочные металлы - это элементы первой группы периодической системы, которые включают литий, натрий, калий, рубидий и цезий. Они имеют свойства активных металлов и обладают наибольшими атомными радиусами среди всех элементов в периоде.
Разрывы между атомными радиусами щелочных металлов обусловлены изменением зарядов ядер и внешних электронных оболочек. Литий, имеющий наименьший атомный радиус среди щелочных металлов, имеет наибольший заряд ядра, что приводит к сильному притяжению электронов и уменьшению размера атома.
Натрий, следующий элемент в группе, имеет больший атомный радиус, чем литий, так как его заряд ядра больше, но не настолько сильно, чтобы притянуть электроны и сжать атом. Калий, рубидий и цезий имеют еще большие атомные радиусы, так как их заряды ядер дальше удаляются от внешних электронных оболочек.
Таким образом, разрывы между атомными радиусами щелочных металлов возникают из-за изменения зарядов ядер и электронных оболочек. Эти различия в размерах могут приводить к разным химическим и физическим свойствам элементов группы, таким как реактивность и способность образовывать ионы.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций.
Что такое атомный радиус?
Атомный радиус - это характеристика размера атома, которая показывает расстояние от ядра атома до самого внешнего электрона, когда атом находится в нейтральном состоянии.
Почему щелочные металлы имеют наибольший атомный радиус?
Щелочные металлы имеют наибольший атомный радиус из-за своей электронной конфигурации. У них всего один электрон в самом внешнем энергетическом уровне, что создает сильное отталкивание между электронами, и атом старается расшириться, чтобы уменьшить отталкивание. В результате атомы щелочных металлов имеют больший размер по сравнению с атомами других элементов.
Как изменяется атомный радиус щелочных металлов в периоде?
Атомный радиус щелочных металлов уменьшается в периоде при движении слева направо. Это происходит из-за увеличения эффективного заряда ядра, что приводит к сильному притяжению электронов и сжатию атома. Таким образом, наибольший атомный радиус будет у щелочных металлов в первой группе периодической системы.
