Надпероксиды щелочных металлов представляют собой класс химических соединений, обладающих высокой степенью окисления. Они образуются при реакции щелочных металлов с кислородом и имеют общую формулу МO2, где М обозначает металл. Щелочные металлы, такие как литий, натрий и калий, являются очень активными элементами, способными образовывать стабильные надпероксиды.
Одной из основных особенностей надпероксидов щелочных металлов является их способность к самовоспламенению. Их реакция с воздухом протекает с выделением большого количества тепла, что может привести к возникновению пожара. Поэтому хранение и использование надпероксидов щелочных металлов требует особой осторожности и огнезащитных мероприятий.
Степень окисления надпероксидов щелочных металлов находится на самом высоком уровне, что делает их очень нестабильными соединениями. Они являются сильными окислителями и могут взаимодействовать с различными веществами, в том числе с органическими соединениями. Это свойство делает надпероксиды щелочных металлов полезными в различных областях химической промышленности и лабораторных исследованиях.
Структура и состав надперокислых соединений
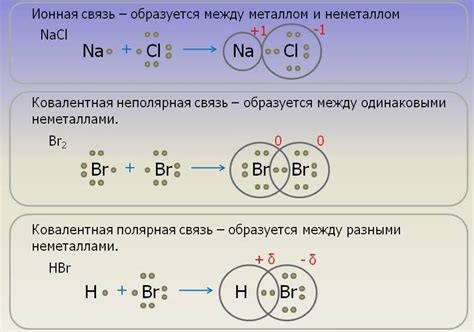
Надперокислые соединения щелочных металлов представляют собой химические соединения, которые обладают особой структурой и составом. Основным элементом структуры надперокислых соединений является пероксидный мост, связывающий два атома кислорода. Эта особенность позволяет им обладать высокой активностью и антиоксидантными свойствами.
Структура надперокислых соединений представляет собой цепочку атомов щелочного металла, связанных с атомами кислорода через пероксидные мосты. Внутри данной структуры происходят различные химические реакции, которые позволяют надперокислы участвовать в разнообразных процессах окисления и деградации органических веществ.
Состав надперокислых соединений также включает другие элементы, такие как вода, гидроксиды и катионы щелочных металлов. Эти компоненты играют важную роль в обеспечении стабильности и активности надперокислов.
Структура и состав надперокислых соединений зависят от различных факторов, таких как условия синтеза, концентрация исходных веществ, температура и давление. При изменении этих параметров могут меняться свойства и реакционная способность надперокислого соединения.
Физические свойства надперокислых соединений

Устойчивость: Надперокислые соединения щелочных металлов обладают высокой устойчивостью и не подвергаются легкому разложению при обычных условиях.
Цвет: В зависимости от металла, надперокислые соединения могут иметь разные цвета. Например, надпероксид натрия имеет желтый цвет, а надпероксид калия - белый.
Температура плавления: Температура плавления надперокислых соединений обычно высокая. Например, надпероксид натрия плавится при температуре около 460 градусов Цельсия.
Теплопроводность: Надперокислые соединения обладают низкой теплопроводностью, что связано с их кристаллической структурой и наличием большого количества связей между атомами.
Растворимость: Надперокислые соединения обычно нерастворимы в воде, однако они могут растворяться в других растворителях, таких как органические растворители и газы.
Электропроводность: Надперокислые соединения обладают низкой электропроводностью в твердом состоянии, но могут проявлять электролитические свойства при растворении в воде.
Химические реакции надперокислых соединений
Надперокислые соединения щелочных металлов обладают высокой реакционной способностью и могут участвовать в различных химических реакциях.
Одной из наиболее известных реакций надперокислых соединений является их распад, сопровождающийся выделением кислорода. Эта реакция происходит с образованием соответствующих пероксидов:
- надпероксид натрия (Na2O2) распадается с образованием пероксида натрия (Na2O);
- надпероксид калия (KO2) распадается с образованием пероксида калия (K2O);
- надпероксид лития (LiO2) распадается с образованием пероксида лития (Li2O).
Важной химической реакцией надперокислых соединений является их реакция с водой. При этом происходит образование соответствующих оксидов щелочных металлов и выделение кислорода:
- надпероксид натрия (Na2O2) реагирует с водой, образуя гидроксид натрия (NaOH) и кислород (O2);
- надпероксид калия (KO2) реагирует с водой, образуя гидроксид калия (KOH) и кислород (O2);
- надпероксид лития (LiO2) реагирует с водой, образуя гидроксид лития (LiOH) и кислород (O2).
Также надперокислые соединения могут вступать в реакцию с кислородом, образуя супероксиды. Например, надпероксид калия (KO2) вступает в реакцию с кислородом, образуя супероксид калия (KO2):
2KO2 + O2 → 2KO2
Степень окисления щелочных металлов в надперокислых соединениях

Степень окисления щелочных металлов в надперокислых соединениях зависит от количества кислорода, связанного с каждым атомом металла. Щелочные металлы вступают в реакцию с кислородом, образуя надпероксиды, в которых металл имеет степень окисления +1.
Например, надперокись натрия (Na₂O₂) содержит два атома кислорода, связанных с одним атомом натрия. Это означает, что натрий в надперокиси имеет степень окисления +1.
Также существуют надпероксиды других щелочных металлов, такие как надперокись калия (K₂O₂) и надперокись лития (Li₂O₂). Во всех этих соединениях металлы имеют степень окисления +1, так как они вступают в реакцию с кислородом и образуют соединения с двумя атомами кислорода.
Степень окисления щелочных металлов в надперокислых соединениях указывает на потенциал металлов для активного взаимодействия с другими веществами. Это позволяет использовать надперокиси щелочных металлов в различных химических реакциях, включая окислительные процессы и синтез соединений с определенными свойствами.
Вопрос-ответ

Что такое надпероксиды щелочных металлов?
Надпероксиды щелочных металлов - это соединения, в которых металл образует высокостепенное соединение с кислородом. Они обладают устойчивостью к воздействию влаги и могут использоваться как кислородные источники.
Какова степень окисления в надпероксидах щелочных металлов?
Степень окисления в надпероксидах щелочных металлов равна -1/2
Что происходит при разложении надпероксидов щелочных металлов?
При разложении надпероксидов щелочных металлов образуется пероксид и кислород. Реакция разложения происходит с выделением тепла.
