Внешний слой атома называется валентным, и он играет важную роль в химических реакциях и связях. У атомов щелочных металлов, таких как литий, натрий, калий и др., валентный слой состоит из одного электрона. Это делает эти элементы очень активными и легко реагирующими с другими веществами.
По своей природе щелочные металлы являются мягкими, легкими и хорошо проводящими тепло и электричество. Их реактивность определяется именно наличием одного электрона в валентном слое. Этот электрон легко отдаётся, образуя положительный ион. Это объясняет их способность легко реагировать с водой и взрываться при контакте с воздухом.
Атомы щелочных металлов образуют ионы с одной положительной зарядом, потому что при реакциях они теряют электрон. Поэтому они активно взаимодействуют с веществами, составляющими окружающую среду, такими как вода, кислород и другие элементы. Такие реакции электронного переноса являются ключевыми во многих процессах, включая синтез химических соединений и функционирование биологических систем.
На основе этих свойств щелочные металлы широко используются в различных областях, включая промышленность, медицину и электротехнику. Их способность образовывать стабильные соединения с другими элементами позволяет создавать различные соединения с желаемыми свойствами и применением. В то же время, их высокая реактивность требует особого внимания и мер предосторожности при работе с ними.
Структура атомов щелочных металлов

Атомы щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и другие, имеют особую структуру. У этих атомов в внешнем энергетическом уровне находится по одному электрону, что делает их химически активными.
Все атомы состоят из ядра и облака электронов. Ядро содержит протоны и нейтроны, которые называются нуклонами. Протоны имеют положительный заряд, а нейтроны не имеют заряда. На облаке электронов находятся электроны, которые обращаются вокруг ядра на определенных энергетических уровнях.
Атомы щелочных металлов имеют один электрон во внешнем энергетическом уровне. Этот электрон находится далеко от ядра и легко подвергается воздействию других атомов или молекул. Именно благодаря этим химическим свойствам щелочные металлы обладают большой активностью и используются в различных химических реакциях и промышленных процессах.
В качестве примера можно привести литий, который имеет электронную конфигурацию 2-1. Это означает, что в первом энергетическом уровне лития находится 2 электрона, а во втором - 1 электрон, что и делает его внешний слой. Благодаря этой структуре литий легко образует ион Li+, отдавая свой внешний электрон.
Ионизация внешнего слоя атомов щелочных металлов
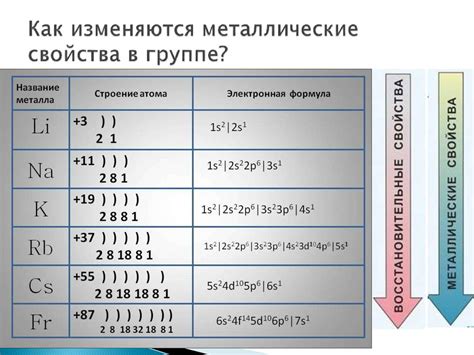
Щелочные металлы – это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. У всех этих элементов на внешнем электронном слое находится по одному электрону.
Ионизация атома происходит, когда из атома удаляется один или несколько электронов. В случае щелочных металлов, ионизация внешнего слоя атомов осуществляется, когда удаляется один электрон.
Один электрон на внешнем слое атома щелочного металла обладает низкой энергией и слабо привязан к ядру. Поэтому ионизация этого электрона требует небольшого энергетического затраты. При этом, ионизационная энергия, необходимая для отделения внешнего электрона от атома щелочного металла, минимальна в периодической системе элементов.
Из-за низкой ионизационной энергии, атомы щелочных металлов легко теряют внешний электрон и образуют положительно заряженные ионы. Это явление обуславливает их высокую химическую реактивность, так как ионы щелочных металлов стремятся компенсировать положительный заряд, претерпевая реакции с другими элементами или веществами.
Химические свойства атомов щелочных металлов

1. Высокая реакционная способность: Атомы щелочных металлов обладают высокой реакционной способностью из-за наличия только одного электрона во внешнем электронном слое. Они стремятся отдать этот электрон, чтобы достичь структуры электронов инертного газа и стать ионами с положительным зарядом.
2. Способность к образованию ионов: Атомы щелочных металлов легко образуют положительные ионы, отдавая свой единственный электрон. Например, натрий образует катион Na+ в процессе взаимодействия с другими элементами.
3. Высокая активность в реакциях с водой: Атомы щелочных металлов реагируют с водой, образуя щелочные растворы и выделяя водород. Эта реакция происходит очень быстро и сопровождается выделением тепла.
4. Образование соединений с кислородом: Атомы щелочных металлов реагируют с кислородом, образуя оксиды. Например, натрий образует оксид Na2O, который может реагировать с водой, образуя гидроксид натрия.
5. Высокая электропроводность: Ионы щелочных металлов обладают высокой подвижностью в растворе и могут проводить электрический заряд. Это делает щелочные металлы хорошими проводниками электричества.
6. Участие в реакции обмена: Щелочные металлы могут образовывать соединения с другими элементами, принимая их электроны и образуя ионы отрицательного заряда. Это процесс обмена электронами и называется реакцией обмена.
7. Образование сплавов: Атомы щелочных металлов могут образовывать сплавы с другими металлами, что расширяет их применение в различных областях, таких как производство лёгких конструкционных материалов.
8. Химическая активность по убыванию: Химическая активность атомов щелочных металлов по убыванию растёт от лития к цезию. Наименее активным является литий, наиболее активным - цезий.
9. Образование солей: Щелочные металлы образуют соли с различными антионами, примерами таких солей являются хлорид натрия (NaCl), карбонат калия (K2CO3) и нитрат лития (LiNO3).
Вопрос-ответ

Какие именно щелочные металлы имеют по одному электрону на внешнем слое?
На внешнем слое атомов щелочных металлов находится по одному электрону у всех элементов этой группы - лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr).
Какую роль играет внешний слой атомов щелочных металлов?
Внешний слой атомов щелочных металлов определяет их химические свойства и реактивность. Это слой, находящийся на самой внешней оболочке атома, содержит по одному свободному электрону, что делает щелочные металлы очень реакционно-активными.
Почему именно по одному электрону на внешнем слое?
Каждый атом щелочного металла имеет электронную конфигурацию ns1, где n - главное квантовое число, s - тип орбитали. Поэтому на внешнем слое находится только один s-электрон.
Какая связь между количеством электронов на внешнем слое и реактивностью щелочных металлов?
Чем больше щелочный металл имеет электронов на внешнем слое, тем более реакционно-активным он является. Так, франций, у которого на внешнем слое находится только один электрон, является самым реакционно-активным из всех щелочных металлов.
В каких соединениях щелочные металлы участвуют?
Щелочные металлы образуют соединения с различными элементами, обычно уступая свой электрон на внешнем слое. Они вступают в реакции с водой, кислородом, нефтью, серой, фосфором и другими веществами, образуя оксиды, гидроксиды, соли и другие соединения.
