Внешний энергетический уровень атома металла играет важную роль в его химических и физических свойствах. Он определяет, как атом взаимодействует с другими атомами и какие связи он может образовывать.
Когда атом металла находится в поверхностном состоянии, его электроны находятся в валентной зоне. Эти электроны, называемые валентными электронами, находятся на самом внешнем энергетическом уровне и обладают наибольшей энергией. Валентные электроны также определяют химическую активность атома металла.
Валентные электроны могут участвовать в химических реакциях, образуя химические связи с другими атомами. Они могут быть переданы или разделяться с другими атомами, образуя положительно или отрицательно заряженные ионы. В результате таких реакций металлы могут образовывать различные соединения, такие как соли или металлические сплавы.
Состояние внешнего энергетического уровня атома металла также влияет на его физические свойства, такие как плотность, теплопроводность и электропроводность. Структура внешней оболочки и взаимодействие электронов на этом уровне определяют эти свойства. Высокая плотность и хорошая электропроводность металлов связаны с их способностью образовывать межатомные связи и эффективно передавать электроны.
Металлические атомы и их энергетические уровни
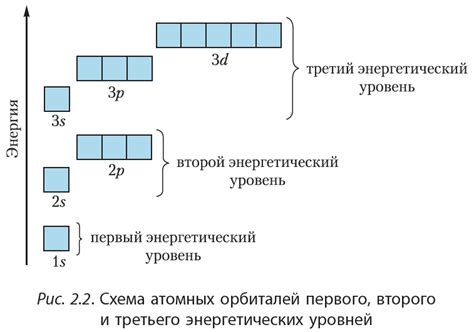
Металлические атомы обладают особенной структурой энергетических уровней. У каждого металла есть свои характерные особенности в распределении электронов по энергетическим уровням.
Наиболее важным для определения свойств металлов является внешний энергетический уровень, на котором находятся валентные электроны металлического атома. Валентные электроны отвечают за химические свойства металла и его способность образовывать соединения с другими элементами.
Число валентных электронов металлического атома является одним из основных характеристик металла. Оно определяет его химическую активность и способность образовывать ионные или ковалентные связи с другими атомами.
Большинство металлов в периодической системе химических элементов находятся в группах с номерами от 1 до 12. В этих группах находятся металлы, имеющие 1-2 валентных электрона на внешнем энергетическом уровне. Однако, есть и исключения, например, металлы из группы железа (группа 8) имеют 2 валентных электрона.
Состав атомов металла

Атомы металлов состоят из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, образуя маленькую и плотную часть атома. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Число протонов определяет химические свойства атома и называется атомным номером.
Вокруг ядра движутся электроны, образуя оболочку. Электроны имеют отрицательный заряд и распределяются на энергетических уровнях. Наиболее близкие к ядру электроны имеют меньшую энергию, а те, которые находятся на более дальних уровнях, имеют большую энергию.
Число электронов в атоме металла равно числу протонов в ядре и определяется атомным номером. Однако, атом может иметь несколько энергетических уровней и различное число электронов на каждом из них. Например, атом железа имеет 26 протонов и 26 электронов. Эти электроны образуют оболочки, первая из которых содержит 2 электрона, вторая - 8 электронов, а третья - 14 электронов.
Что такое энергетические уровни атомов металла?
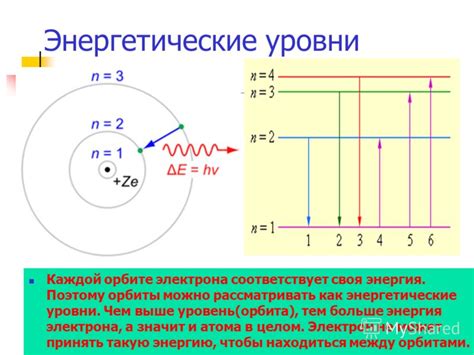
Энергетические уровни атомов металла – это различные энергетические состояния, которые может принимать электрон в атоме металла. Эти уровни представляют собой дискретные значения энергии, на которых находятся электроны.
Как известно, электрон в атоме может занимать только определенные энергетические уровни, называемые квантовыми состояниями. Эти уровни обладают определенными энергиями и связаны с определенными орбитальными состояниями электрона.
В атомах металла электроны распределены по энергетическим уровням согласно принципу заполнения энергетических уровней. Это означает, что электроны заполняют уровни в порядке возрастания их энергии, начиная с наименьшей энергии.
Энергетические уровни атомов металла играют важную роль в определении свойств материала. Количество энергетических уровней, а также их заполнение электронами, определяет электропроводность, теплопроводность, магнитные свойства и другие характеристики металла.
Изучение энергетических уровней атомов металла позволяет понять, почему некоторые металлы обладают определенными свойствами и как эти свойства могут быть изменены путем взаимодействия с другими элементами или с изменением условий окружающей среды.
Значение внешнего энергетического уровня
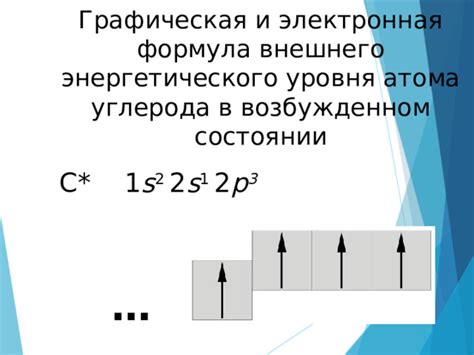
Внешний энергетический уровень атомов металла играет важную роль в их химических свойствах. Он определяет способность атома образовывать химические связи с другими атомами и взаимодействовать с окружающей средой. Внешние электроны находятся на самом внешнем энергетическом уровне и называются валентными электронами.
Количество валентных электронов в атоме металла определяет его химическую активность. Чем больше валентных электронов у атома, тем большую склонность он проявляет к образованию химических связей с другими атомами. Количество валентных электронов можно определить по номеру группы в таблице Менделеева, так как оно обычно равно номеру группы за исключением групп 3-12.
Валентные электроны атомов металла могут участвовать в образовании свободных электронов в металлическом кристалле или образовывать связи с электронами атомов других элементов. Это объясняет способность металлов проводить электрический ток и быть хорошими проводниками тепла. Также валентные электроны влияют на металлический блеск и формирование специфических кристаллических структур.
Влияние состояния внешнего энергетического уровня на свойства металла

Свойства металла в значительной степени определяются состоянием его внешнего энергетического уровня. Внешний энергетический уровень, также известный как валентная оболочка, представляет собой наиболее внешний электронный уровень в атоме металла.
Состояние внешнего энергетического уровня определяет химическую активность металла, его способность образовывать химические связи с другими атомами и ионы. Металлы с полностью заполненной внешней оболочкой стабильны и мало реактивны, так как не имеют свободных электронов, способных вступать в химические связи.
Однако у металлов с неполностью заполненной внешней оболочкой состояние внешнего энергетического уровня играет ключевую роль в их свойствах. Непарные электроны на внешнем энергетическом уровне создают возможность для образования химических связей и влияют на проводимость электричества и тепла в металле.
Кроме того, состояние внешнего энергетического уровня определяет эффективность атомов металла в формировании кристаллической структуры. Силы межатомных взаимодействий на микроскопическом уровне зависят от конфигурации электронных оболочек, что влияет на механические свойства металла, такие как прочность и пластичность.
Внешний энергетический уровень и реактивность металла

Атомы металла обладают особенной структурой электронных оболочек, которая определяет их реактивность. Внешний энергетический уровень, или валентная оболочка, играет важную роль в этом процессе.
Валентная оболочка содержит электроны, которые наиболее легко переходят во внешнюю оболочку других атомов при взаимодействии с ними. Чем более заполнен этот энергетический уровень, тем меньше энергии требуется для перехода электронов, и, следовательно, металл будет более реактивным.
Реактивность металла также может быть связана с наличием непарных электронов на внешнем энергетическом уровне. Это позволяет металлам легче участвовать в химических реакциях, образуя соединения с другими веществами.
Металлы с неполностью заполненной или полностью заполненной валентной оболочкой часто обладают большей реактивностью. Например, металлы из группы активных металлов, таких как натрий и калий, имеют одну электрон на внешнем энергетическом уровне и легко реагируют с водой и кислородом.
Однако, есть и металлы с заполненной валентной оболочкой, такие как золото и платина, которые обычно не проявляют высокой реактивности. Это связано с тем, что их электронные оболочки уже стабилизированы, и металлы не стремятся к образованию химических соединений.
Металлы с полностью заполненным внешним энергетическим уровнем

Металлы, у которых внешний энергетический уровень полностью заполнен электронами, обладают определенными свойствами, которые отличают их от других элементов. Такие металлы имеют высокие точки плавления и кипения, что делает их идеальными материалами для использования в различных технических и промышленных процессах.
Один из примеров таких металлов – алюминий. Его внешний энергетический уровень содержит 3 электрона, что полностью заполняет его. Благодаря этому, алюминий обладает высокой электропроводностью и высокой теплопроводностью. Кроме того, алюминий легкий и хорошо поддаётся обработке, поэтому он широко используется в различных отраслях промышленности, включая авиацию, строительство и упаковку.
Другой пример металлов с полностью заполненным внешним энергетическим уровнем – медь. Внешний энергетический уровень меди содержит 1 электрон, что делает её очень стабильной. Это позволяет меди быть отличным проводником электричества и тепла. Медь также оказывает сильное антибактериальное действие, что делает её полезной для использования в медицинских инструментах и поверхностях.
Также стоит отметить, что металлы с полностью заполненным внешним энергетическим уровнем обычно имеют высокую плотность и твёрдые свойства. Это делает их прочными и устойчивыми к деформациям и износу. Такие металлы, в том числе железо и никель, широко применяются в строительстве, машиностроении и производстве различной техники и снаряжения.
Значение энергетического уровня для металлических соединений
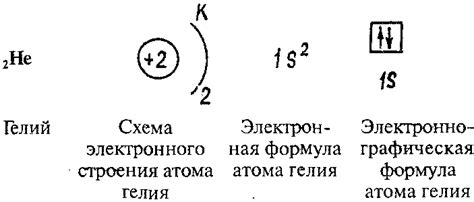
Атомы металла обладают свободными (незанятыми электронами) на внешнем энергетическом уровне, что делает их особенно податливыми для образования соединений с другими элементами. Значение энергетического уровня атомов металла диктует их химическое поведение и свойства, такие как проводимость электричества и тепла, пластичность, магнитные свойства и другие.
Внешний энергетический уровень атомов металла обычно находится относительно низко по энергии и содержит только несколько электронов. Благодаря этому, атомы металла могут легко отдавать электроны другим элементам, образуя ионные или ковалентные соединения. Именно эта способность металлов образовывать соединения является их основным химическим свойством.
Значение энергетического уровня также определяет природу связи между атомами в металлических соединениях. В металлических кристаллах атомы металла образуют сеть положительно заряженных ионов, окруженных облаком свободных электронов. Эти свободные электроны способны свободно двигаться и создавать эффект коллективности, который обуславливает многие особенности металлов, такие как высокая проводимость электричества и тепла.
- Энергетический уровень атомов металла определяет химическое поведение и свойства металлов.
- Атомы металла могут легко отдавать электроны, образуя соединения с другими элементами.
- Значение энергетического уровня определяет природу связи между атомами в металлических соединениях.
- Сеть положительно заряженных ионов и облако свободных электронов обуславливают основные свойства металлов.
Вопрос-ответ

Что такое энергетический уровень атома металла?
Энергетический уровень атома металла - это уровень энергии, который занимает электрон на атоме металла. Он определяет состояние электрона и его возможности для взаимодействия с другими электронами и атомами.
Какие внешние энергетические уровни можно найти у атома металла?
У атома металла могут быть различные внешние энергетические уровни. Они определяются количеством электронов на внешнем энергетическом уровне и их распределением. Например, атом металла может иметь один или несколько электронов на внешнем энергетическом уровне.
Как энергетический уровень атома металла влияет на его свойства?
Энергетический уровень атома металла оказывает влияние на его свойства, так как определяет способность атома металла взаимодействовать с другими атомами и электронами. Он также влияет на способность атома металла проводить электрический ток, плавиться и испаряться при нагреве, а также на его химическую активность.
Какая связь между внешним энергетическим уровнем атома металла и его валентностью?
Валентность атому металла зависит от количества электронов на внешнем энергетическом уровне. Валентность указывает на количество электронов, которые атом может отдать или принять при взаимодействии с другими атомами. Чем больше электронов на внешнем энергетическом уровне, тем выше валентность атома металла.
