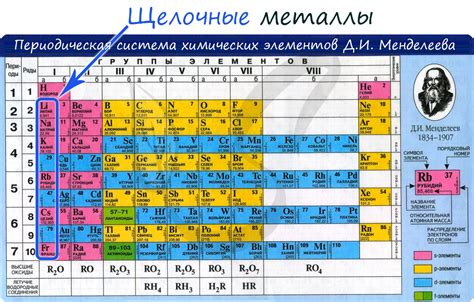
Атомы щелочных металлов - низкоактивные элементы периодической системы, которые находятся в первой группе этой таблицы. Они обладают особым свойством - на их внешнем энергетическом уровне могут находиться только 1, 2 или 3 электрона. Данная особенность влияет на их реактивность и роль в многих химических процессах.
Все щелочные металлы находятся в первой группе периодической системы, так как у них в внешней электронной оболочке находится всего один электрон. Натрий, калий, рубидий, цезий и франций имеют по одному электрону на внешнем энергетическом уровне, что делает их очень реактивными. Они легко отдают лишний электрон, чтобы образовать положительный ион.
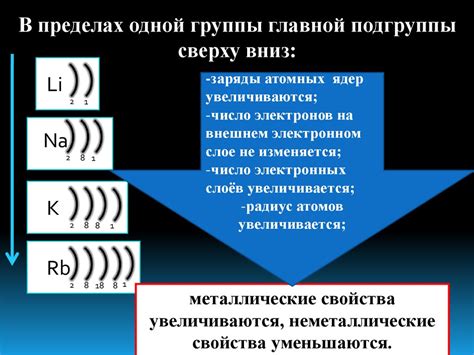
Однако второй и третий периоды щелочных металлов - литий, натрий и калий - имеют внутренний s-блок, который заполняется одним, двумя или тремя электронами на внешней оболочке. Это объясняет, почему щелочные металлы могут иметь 1, 2 или 3 электрона на внешнем энергетическом уровне.
Это положение электронов на внешнем энергетическом уровне играет решающую роль во многих свойствах и реактивности щелочных металлов. Это также влияет на их способность образовывать ионы, связываться с другими элементами и участвовать в химических реакциях.
Вывод: количество электронов на внешнем энергетическом уровне щелочных металлов влияет на их химическую активность и способность образовывать соединения. Знание этой особенности помогает понять и объяснить много явлений, связанных с реактивностью этих элементов.
Внешний энергетический уровень атомов щелочных металлов

На внешнем энергетическом уровне атомы щелочных металлов могут иметь 1, 2 или 3 электрона. Это свойство определяет их реакционную способность и химические свойства.
Атомы щелочных металлов, таких как литий, натрий и калий, имеют один электрон на внешнем энергетическом уровне. Это делает их очень реакционноспособными и склонными к образованию ионов положительного заряда. Эти металлы активно взаимодействуют с другими элементами, образуя соли и ионы в реакциях.
Другие щелочные металлы, такие как рубидий и цезий, имеют два электрона на внешнем энергетическом уровне. Это делает их еще более реакционноспособными, чем металлы с одним электроном. Они могут образовывать стабильные ионы с положительным зарядом и могут быть использованы в различных химических реакциях.
Самые тяжелые щелочные металлы, такие как франций, имеют три электрона на внешнем энергетическом уровне. Их реакционная способность и химические свойства могут быть даже более выраженными, чем у легких щелочных металлов. Франций является самым редким и радиоактивным из всех щелочных металлов и имеет ограниченное применение в научных исследованиях и ядерной физике.
Щелочные металлы и их электроны
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, относятся к первой группе периодической таблицы элементов. На внешнем энергетическом уровне атомы этих металлов имеют 1, 2 или 3 электрона, что делает их очень реактивными материалами.
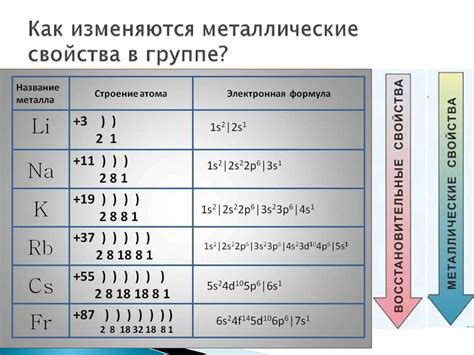
Электроны в щелочных металлах играют ключевую роль в их химических свойствах. У атома лития, находящегося в первой группе, всего один электрон на внешнем энергетическом уровне. Этот один электрон относительно слабо удерживается ядром атома, поэтому литий легко отдает его другим атомам, формируя положительный ион.
Натрий и калий, находящиеся соответственно во второй и третьей группе периодической таблицы, имеют два и три электрона на внешнем энергетическом уровне, соответственно. Эти дополнительные электроны делают атомы натрия и калия еще более реактивными, что отражается в их способности образовывать положительные ионы и растворяться в воде.
Таким образом, электроны в щелочных металлах являются определяющим фактором их химического поведения. Изучение и понимание электронной структуры этих металлов позволяет нам лучше понять их свойства и взаимодействия с другими веществами.
Количество электронов на внешнем энергетическом уровне
Атомы щелочных металлов - натрия, калия, рубидия и цезия - имеют особую характеристику: на их внешнем энергетическом уровне может находиться 1, 2 или 3 электрона. Это означает, что эти атомы легко взаимодействуют с другими атомами и могут образовывать соединения с различными элементами.
Количество электронов на внешнем энергетическом уровне определяет химические свойства щелочных металлов. Например, натрий имеет один электрон на внешнем энергетическом уровне, что делает его химически активным и способным образовывать ион с положительным зарядом Na+. Калий, с двумя электронами на внешнем энергетическом уровне, образует ион K+.
Еще более интересные свойства проявляются у рубидия и цезия, у которых на внешнем энергетическом уровне находятся три электрона. Это делает их самыми реактивными и щелочными металлами. Когда они взаимодействуют с водой, они быстро реагируют, выделяя водород и образуя щелочные гидроксиды.
Количество электронов на внешнем энергетическом уровне является важным параметром, который определяет взаимодействия атомов и их свойства. Это является основой химии щелочных металлов и позволяет объяснить, почему они образуют только ионы с положительным зарядом и легко вступают в реакции с другими веществами.
Взаимодействие атомов щелочных металлов с другими элементами
Атомы щелочных металлов – лития, натрия, калия, рубидия, цезия и франция – имеют особенности взаимодействия с другими элементами, благодаря своей электронной конфигурации на внешнем энергетическом уровне. Щелочные металлы находятся в первой группе периодической системы и имеют один электрон на внешнем энергетическом уровне.
Этот одиночный электрон на внешнем уровне делает атомы щелочных металлов очень реакционными. Они стремятся отдать этот электрон, чтобы достичь стабильной восьмиэлектронной конфигурации. Взаимодействие атомов щелочных металлов с другими элементами может приводить к различным реакциям и образованию соединений.
Вода, кислород, сера, фтор, хлор, бром и йод – это некоторые из элементов, с которыми атомы щелочных металлов могут взаимодействовать. Взаимодействие с водой приводит к образованию щелочных гидроксидов. Натрий, калий и другие щелочные металлы реагируют с водой, образуя гидроксид и выделяя водород.
Взаимодействие атомов щелочных металлов с кислородом может приводить к образованию оксидов и пероксидов. Например, натрий при сгорании с кислородом образует оксид натрия. Взаимодействие с серой может привести к образованию сульфидов, а с галогенами – к образованию халогенидов.
Особенности взаимодействия атомов щелочных металлов с другими элементами позволяют использовать эти металлы в различных областях, включая промышленность, металлургию, медицину и энергетику. Они широко используются в производстве лекарств, батареях и солнечных батареях, а также в качестве катализаторов в химических реакциях.
Энергетический уровень и химические свойства щелочных металлов

Щелочные металлы - это группа элементов периодической системы, которые на внешнем энергетическом уровне имеют 1, 2 или 3 электрона. Их электронная конфигурация является основным фактором, определяющим их химические свойства.
На внешнем энергетическом уровне у щелочных металлов находится всего один электрон. Это делает их очень реактивными и легко ионизирующимися. Щелочные металлы очень активно взаимодействуют с водой, воздухом и другими веществами, образуя щелочи.
Катионы щелочных металлов обладают положительным зарядом и имеют тенденцию объединяться с отрицательно заряженными ионами, что приводит к образованию солей. Например, натрий реагирует с хлором, образуя хлорид натрия - распространенную соль, применяемую в пищевой промышленности.
Щелочные металлы также способны образовывать сплавы с другими металлами, что делает их важными компонентами в металлургической и электротехнической промышленности. Сплавы щелочных металлов обладают высокой электропроводимостью и химической устойчивостью.
Важно отметить, что у щелочных металлов низкая температура плавления и высокая теплопроводность, что делает их полезными в различных технических и промышленных приложениях.
Щелочные металлы также проявляют специфические свойства в химических реакциях. Они могут образовывать комплексы с различными лигандами, что является основой для использования их в катализе и других химических процессах.
В заключение, энергетический уровень щелочных металлов и их химические свойства неразрывно связаны. Их активность, реактивность и способность образовывать соединения делают их незаменимыми в различных областях науки и промышленности.
Вопрос-ответ

Почему атомы щелочных металлов имеют на внешнем энергетическом уровне 1, 2 или 3 электрона?
Атомы щелочных металлов имеют на внешнем энергетическом уровне 1, 2 или 3 электрона из-за их электронной конфигурации. В электронной оболочке атома находятся электроны, которые располагаются в разных энергетических уровнях. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, находятся в первой группе периодической системы элементов и имеют одну, две или три электронные оболочки, соответственно. Поэтому у атомов щелочных металлов на внешнем энергетическом уровне находится 1, 2 или 3 электрона.
Какая связь есть между количеством электронов на внешнем энергетическом уровне атомов щелочных металлов и их химическими свойствами?
Количество электронов на внешнем энергетическом уровне атомов щелочных металлов напрямую влияет на их химические свойства. Эти металлы обладают высокой химической активностью и легкостью реакции с другими веществами, что связано с наличием одного, двух или трёх электронов на внешнем энергетическом уровне. Они стремятся избавиться от этих электронов и образовать ионы с положительным зарядом. Такие ионы, например, Na+, Li+ или K+, легко связываются с ионами отрицательного заряда или с молекулами и образуют кристаллические решетки солей и ряд других соединений.
Какие процессы происходят, когда атомы щелочных металлов теряют электроны на внешнем энергетическом уровне?
Когда атомы щелочных металлов теряют электроны на внешнем энергетическом уровне, происходит процесс ионизации. Это значит, что атом приходит в состояние с положительным зарядом, так как число протонов в ядре превышает число электронов. В результате электронные оболочки атомов щелочных металлов становятся электронами, которые свободно перемещаются между атомами, образуя проводимый электрический ток. Это объясняет электрическую проводимость щелочных металлов и их способность быть использованными в элементах электрических цепей и батареях.
