Электронная конфигурация иона двухвалентного металла представляет собой последовательность электронных оболочек и подуровней, заполненных электронами. В данной статье мы рассмотрим возможность электронной конфигурации, представленной следующей последовательностью: 1s2 2s2 2p6 3s2 3p6.
Для начала, 1s2 означает, что на первой электронной оболочке находится 2 электрона. Затем, 2s2 указывает на присутствие еще 2 электронов на второй электронной оболочке. Последующие 2p6 указывают на наличие 6 электронов на второй электронной оболочке, которые располагаются на трех подуровнях: px, py, pz.
Далее, 3s2 указывает на наличие 2 электронов на третьей электронной оболочке. И, наконец, 3p6 означает присутствие еще 6 электронов на третьей электронной оболочке, которые также располагаются на подуровнях px, py, pz.
Таким образом, общее число электронов в ионе двухвалентного металла с такой электронной конфигурацией равно 2 + 2 + 6 + 2 + 6 = 18. Это означает, что в ионе присутствуют 18 электронов.
Что такое электронная конфигурация?
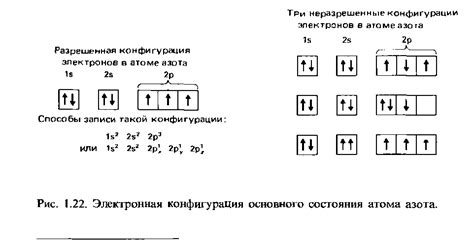
Электронная конфигурация обозначает распределение электронов в атоме, молекуле или ионе по энергетическим уровням и атомным орбиталям. Она позволяет описать, какие энергетические уровни заняты электронами и каким образом электроны распределены по орбиталям.
Каждый элемент имеет свою уникальную электронную конфигурацию, которая определяется количеством электронов и их распределением на энергетических уровнях и орбиталях. Наиболее стабильная электронная конфигурация элемента обеспечивает его наименьшую энергию.
Запись электронной конфигурации представляет собой последовательность чисел и букв, обозначающих, сколько электронов находится на каждом энергетическом уровне и на каких орбиталях. Например, электронная конфигурация атома кислорода (О) - 1s2 2s2 2p4, что означает наличие 2 электронов на 1s-уровне, 2 электронов на 2s-уровне и 4 электронов на 2p-уровне.
Электронная конфигурация важна для определения химических свойств элементов и их способности вступать в химические реакции. Зная электронную конфигурацию иона или молекулы, можно предсказать его взаимодействие с другими веществами и его химическую активность.
Понятие электронной конфигурации

Электронная конфигурация - это упорядоченное расположение электронов в атоме, ионе или молекуле. Она описывает распределение электронов по энергетическим уровням и подуровням в атоме. Электронная конфигурация является основой для понимания химических свойств и реакций вещества.
Первый приближенный вариант электронной конфигурации задается по правилу Клейна-Гордона, которое заключается в расположении электронов в атоме по возрастанию их энергии. Начиная с самых низколежащих энергетических уровней, электроны заполняют более низкие энергетические уровни вплоть до достижения наиболее высоколежащих.
Каждый энергетический уровень атома представляет собой энергетическую оболочку, которая включает подуровни. Подуровни могут содержать различное количество электронов. Правилам заполнения подуровней соответствует также правило Гунда. По этому правилу, каждая электронная пара, имеющая собственную орбиталь, будет иметь пониженную энергетику электрона. Поэтому каждая орбиталь и подуровень, очерчивающие электроны, предпочитаются резервировать.
Электроны с наименьшей энергией находятся ближе к ядру атома, а электроны с более высокой энергией находятся дальше от ядра. Это с помощью электронной конфигурации можно объяснить различие в химических свойствах ионов.
Значение электронной конфигурации

Электронная конфигурация является основополагающим понятием в химии и физике, описывающим распределение электронов в атоме или ионе. Она представляет собой запись, которая указывает на количество электронов, находящихся в каждом энергетическом уровне и орбитали атома или иона.
Электронная конфигурация иона двухвалентного металла, такого как ион Fe2+, можно записать следующим образом: 1s2 2s2 2p6 3s2 3p6. Эта запись означает, что в ионе Fe2+ на первом энергетическом уровне находятся 2 электрона, на втором энергетическом уровне - 2 электрона, на третьем энергетическом уровне - 6 электронов в подуровне s и 6 электронов в подуровне p.
Электронная конфигурация играет важную роль в определении химических свойств вещества. Количество электронов в каждом энергетическом уровне определяет реакционную способность ионов и атомов, а также их возможность образовывать химические связи.
Знание электронной конфигурации помогает установить строение и свойства веществ и предсказать их реакционную способность. Это особенно важно при изучении металлов, так как их электронная конфигурация влияет на их физические и химические свойства.
Таким образом, электронная конфигурация является одним из ключевых понятий в химии и физике, позволяющим понять и объяснить свойства веществ и их взаимодействия. Она отражает основные принципы организации электронов в атоме или ионе и позволяет сделать выводы о химическом поведении вещества.
Электронная конфигурация ионов

Электронная конфигурация ионов является важным аспектом изучения химических элементов и их свойств. Ионы образуются при потере или приобретении электронов атомом, что влияет на их электронную конфигурацию и химические свойства.
Для представления электронной конфигурации ионов, используется стандартная нотация, включающая информацию о числе электронов на каждом энергетическом уровне. Например, для двухвалентного металла, электронная конфигурация может быть представлена как 1s2 2s2 2p6 3s2 3p6, указывая на наличие 2 электронов в s-орбиталях, 6 электронов в p-орбиталях и т.д.
Ионы одного и того же элемента могут иметь различную электронную конфигурацию, в зависимости от числа потерянных или приобретенных электронов. Например, железо в состоянии Fe2+ имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 3d6, тогда как железо в состоянии Fe3+ имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 3d5.
Ионы обладают различными свойствами, в зависимости от своей электронной конфигурации. Например, двухвалентные металлы обычно являются стойкими ионами со сверхзарядом, что обуславливает их способность к образованию солей и соединений. Электронная конфигурация ионов играет важную роль в определении их реакционной активности и возможностью образования химических связей с другими элементами.
Что представляет собой ион двухвалентного металла

Ион двухвалентного металла является заряженной частицей, возникающей в результате потери двух электронов атомом металла. Это приводит к изменению электронной конфигурации, что влияет на его физические и химические свойства.
Ионы двухвалентных металлов обладают положительным зарядом, который равен двум элементарным зарядам e. Именно за счет этого заряда ионы металла обладают различными химическими свойствами, включая способность участвовать в реакциях с другими химическими веществами.
Изменение электронной конфигурации атома металла при образовании иона двухвалентного металла связано с переходом электронов на более высокоэнергетические орбитали. Таким образом, ионы двухвалентных металлов обладают валентностью равной 2+.
Ионы двухвалентных металлов имеют большую химическую активность, чем нейтральные атомы того же металла. Это связано с увеличением заряда иона и его способностью принять электроны от других химических веществ. Поэтому ионы двухвалентных металлов широко используются в различных химических реакциях и процессах, включая их участие в образовании соединений и проведение электролиза.
Важно отметить, что каждый ион двухвалентного металла обладает своей характерной электронной конфигурацией, которая определяется его положением в периодической таблице элементов. Это позволяет устанавливать связь между электронной конфигурацией и химическими свойствами ионов двухвалентных металлов.
Возможная электронная конфигурация иона двухвалентного металла
Электронная конфигурация иона двухвалентного металла зависит от его атомной структуры и химических свойств. Возможная электронная конфигурация предлагает информацию о расположении электронов в энергетических оболочках ионов металла.
Рассмотрим пример электронной конфигурации иона двухвалентного металла, основанную на электронной конфигурации нейтрального атома. Выберем атом с электронной конфигурацией 1s2 2s2 2p6 3s2 3p6. Для получения двухвалентного иона, атом теряет два электрона, что приводит к изменению электронной конфигурации.
Таким образом, возможная электронная конфигурация иона двухвалентного металла будет 1s2 2s2 2p6 3s2 3p6, с последними двуми электронами в поглотительной оболочке. Данная конфигурация будет характерной для иона двухвалентного металла и определит его химические свойства и возможные реакции.
Пример конкретной электронной конфигурации иона двухвалентного металла
Рассмотрим пример электронной конфигурации иона двухвалентного металла, где имеется электронная конфигурация 1s2 2s2 2p6 3s2 3p6. Это означает, что металл имеет 12 электронов внешней энергетической оболочки. Для данного иона двухвалентного металла происходит потеря двух электронов, т.е. ион будет иметь электронную конфигурацию 1s2 2s2 2p6 3s2 3p6.
Понимание электронной конфигурации иона двухвалентного металла позволяет определить его химические свойства и реактивность. Так, в данном случае, ион двухвалентного металла имеет положительный заряд 2+, что говорит о том, что он способен отдавать два электрона при взаимодействии с другими элементами.
Ионы двухвалентных металлов широко используются в различных химических и физических процессах. Они могут быть использованы в качестве катализаторов, в производстве сплавов, в электронике и других областях промышленности. Важно отметить, что ион двухвалентного металла обладает определенными свойствами и может образовывать специфические химические связи с другими элементами.
В заключение, примером конкретной электронной конфигурации иона двухвалентного металла является 1s2 2s2 2p6 3s2 3p6. Это позволяет определить его химические свойства и реактивность, а также использовать его в различных областях промышленности.
Вопрос-ответ

Какая электронная конфигурация иона двухвалентного металла?
Электронная конфигурация иона двухвалентного металла может быть разной в зависимости от металла. Возможная электронная конфигурация для иона двухвалентного металла может быть 1s2 2s2 2p6 3s2 3p6.
Какие ионы металлов могут иметь электронную конфигурацию 1s2 2s2 2p6 3s2 3p6?
Ионы двухвалентных металлов могут иметь электронную конфигурацию 1s2 2s2 2p6 3s2 3p6. Такая конфигурация может быть характерной, например, для ионов кальция (Ca2+) или магния (Mg2+), как это представлено в указанной электронной конфигурации.
Почему ион двухвалентного металла может иметь электронную конфигурацию 1s2 2s2 2p6 3s2 3p6?
Ион двухвалентного металла может иметь такую электронную конфигурацию, потому что он будет иметь два отдельных положительных заряда. Во время образования иона двухвалентного металла, атом металла теряет два электрона. Следовательно, электронная конфигурация иона будет отличаться от электронной конфигурации нейтрального атома металла.
