Формирование электродного потенциала на границе металл-электролит является важным явлением в электрохимии и имеет значительное влияние на процессы, происходящие в электролизерах, батареях и других устройствах энергетики. Электродный потенциал возникает в результате разности концентраций и мобильности ионов между металлом и электролитом.
На границе металл-электролит происходит образование двойного электрического слоя. Согласно теории Гельмгольца-Стерна-Гертца, этот слой состоит из двух областей: электронного слоя и диффузионного слоя. В электронном слое происходит движение электронов между металлом и электролитом, а в диффузионном слое – перемещение ионов.
Процесс формирования электродного потенциала начинается с адсорбции ионов на поверхности металла. Эти ионы образуют на поверхности заряженный слой, который притягивает электроны из металла, образуя так называемую "электронную оболочку". Таким образом, на поверхности металла возникает отрицательный заряд, который компенсируется положительными ионами в диффузионном слое. Это создает разность потенциалов между металлом и электролитом.
Электродный потенциал
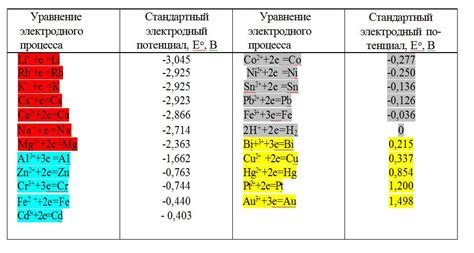
Электродный потенциал – это физическая величина, характеризующая разницу потенциалов между электродом и электролитом на их границе. Потенциал образуется в результате передачи электронов между металлом и электролитом и определяет направление течения электродных реакций.
Формирование электродного потенциала происходит на границе металл-электролит в результате процессов окисления и восстановления. При этом электролит принимает эквивалентное количество электронов от металла, образуя ионную оболочку вокруг электрода. Электродный потенциал зависит от свойств металла и электролита, концентрации ионов в растворе, температуры и других факторов.
Электродный потенциал имеет большое значение в электрохимии, так как он определяет направление и скорость химических реакций на границе металл-электролит. На основе электродного потенциала возможно построение электрохимических систем, таких как аккумуляторы и гальванические элементы. Измерение электродного потенциала позволяет контролировать электрохимические процессы и оптимизировать их эффективность.
- Потенциал образуется на границе металл-электролит;
- Формируется в результате процессов окисления и восстановления;
- Зависит от свойств металла и электролита, концентрации ионов и других факторов;
- Определяет направление и скорость электродных реакций;
- Измерение потенциала позволяет контролировать электрохимические процессы.
Механизм образования
Механизм образования электродного потенциала на границе металл-электролит связан с химическими процессами, происходящими на этой границе. Когда металл находится в контакте с электролитом, происходит обмен электронами между атомами металла и ионами электролита. Этот процесс называется окислительно-восстановительными реакциями.
На поверхности металла происходит окисление металлических атомов, при этом они отдают электроны, превращаясь в положительно заряженные ионы металла. В то же время, ионы электролита принимают эти электроны, происходит их восстановление и образуются отрицательно заряженные ионы. Таким образом, на границе металл-электролит образуется разность зарядов, что приводит к появлению электродного потенциала.
Для наиболее полного понимания механизма образования электродного потенциала необходимо рассмотреть состав металла и электролита, а также их химические свойства и структуру. От этого зависит, какие именно реакции происходят на границе металл-электролит и какие вещества образуются.
Важно отметить, что механизм образования электродного потенциала может также зависеть от внешних условий, например, от температуры и концентрации раствора. Кроме того, электродный потенциал может быть изменен под воздействием электрических полей и других факторов.
Формирование на границе

На границе между металлом и электролитом формируется электродный потенциал, который играет ключевую роль в различных электрохимических процессах. Формирование этого потенциала связано с переходом электронов и ионов через границу металл-электролит.
Первая стадия процесса формирования электродного потенциала - это образование двойного электрического слоя на границе. Двойной электрический слой состоит из двух слоев: слоя ионов, прикрепленных к металлу, и слоя диффузии, в котором происходит сосредоточение ионов из электролита.
Далее, вторая стадия формирования электродного потенциала - это перенос электронов между металлом и электролитом. Электроны переходят с поверхности металла на ионы в слое диффузии. Это создает разность потенциалов между металлом и электролитом, которая является электродным потенциалом.
Кроме того, на формирование электродного потенциала влияют различные факторы, такие как температура, концентрация ионов в электролите, а также свойства поверхности металла. Все эти факторы влияют на скорость переноса электронов и ионов через границу, что в свою очередь влияет на величину электродного потенциала.
Взаимодействие металла и электролита

Взаимодействие металла и электролита играет ключевую роль в формировании электродного потенциала на границе металл-электролит. Оно обуславливает механизмы коррозии и анодной и катодной реакции, что имеет большое значение в различных технических и промышленных процессах.
Взаимодействие металла и электролита осуществляется через образование двух заряженных слоев на поверхности металла – диффузионного слоя и слоя двойного электрического заряда. Диффузионный слой представляет собой область с повышенной концентрацией ионов электролита, граница которой расположена непосредственно на поверхности металла.
В свою очередь, слой двойного электрического заряда образуется за счет обмена электронами между металлом и электролитом. Он является результатом диссоциации ионов электролита и обладает отрицательным зарядом, в то время как металл является областью с положительным зарядом. Таким образом, между металлом и электролитом образуется двойной электрический слой, ограничивающийся диффузионным слоем.
В процессе взаимодействия металла и электролита происходят электрохимические реакции, связанные с переносом зарядов и образованием ионов. Эти реакции определяют уровень электродного потенциала на границе металл-электролит и могут привести к коррозии металла. Изучение этих процессов является важной задачей химии и электрохимии, областей науки, которые исследуют свойства и взаимодействие вещества на уровне атомов и молекул.
Роль ионообменных процессов
Роль ионообменных процессов в формировании электродного потенциала на границе металл-электролит заключается в осуществлении передачи зарядов между металлом и электролитом. Эти процессы происходят благодаря движению ионов в электролите и их взаимодействию с электродом.
В электролите на поверхности металла образуются слои ионов с различными зарядами. При наличии разности потенциалов между металлом и электролитом происходит движение ионов, образуя ток. Этот ток состоит из двух компонентов: ионного тока и электронного тока. Ионный ток связан с перемещением ионов в растворе, а электронный ток - с перемещением электронов в металле.
Ионообменные процессы включают в себя два основных механизма: диффузию и электрохимические реакции. Диффузия осуществляет перемещение ионов в электролите под воздействием их теплового движения. Электрохимические реакции, в свою очередь, происходят при поступлении ионов на поверхность металла и образовании связей между ионами и атомами металла.
Особую роль в ионообменных процессах играют активные элементы металлов, такие как оксиды и гидроксиды, которые образуют пленки на поверхности металла. Эти пленки изменяют химическую и физическую природу поверхности металла, что влияет на процессы ионообмена и, следовательно, на формирование электродного потенциала.
Ионообменные процессы имеют большое значение для понимания механизмов коррозии металлов, а также для разработки новых методов защиты от коррозии. Исследование этих процессов позволяет прогнозировать поведение металлических материалов в коррозионных условиях и разрабатывать эффективные методы их защиты.
Значение для электрохимических реакций

Механизм формирования электродного потенциала на границе металл-электролит играет важную роль в электрохимических реакциях. Электродный потенциал является ключевой характеристикой системы и определяет направление потока электронов при проведении электролиза или других электрохимических процессов.
Значение электродного потенциала зависит от различных факторов, включая концентрацию электролита, температуру, состояние поверхности металла и состояние окружающей среды. Изменение этих параметров может приводить к изменению электродного потенциала и, следовательно, к изменению характера и скорости электрохимической реакции.
Знание механизма формирования электродного потенциала позволяет контролировать электрохимические процессы и управлять ими. Например, при анодной защите металлов от коррозии, электродный потенциал создаваемого анода должен быть достаточно высоким, чтобы препятствовать окислению металла. При электролизе, электродный потенциал выбирается таким образом, чтобы достичь желаемого продукта реакции.
Более того, понимание механизма формирования электродного потенциала на границе металл-электролит позволяет разрабатывать новые электрохимические системы и улучшать существующие. На основе знания о взаимодействии различных электродов и электролитов можно создавать батареи, солнечные панели и другие устройства, в которых происходят электрохимические преобразования.
Вопрос-ответ

Каким образом происходит формирование электродного потенциала на границе металл-электролит?
Механизм формирования электродного потенциала на границе металл-электролит основан на различии в электрохимической активности металла и электролита. Электродный потенциал формируется за счет перемещения электронов между электродом и электролитом.
Какие факторы влияют на формирование электродного потенциала в системе металл-электролит?
На процесс формирования электродного потенциала на границе металл-электролит влияют различные факторы, такие как концентрация электролита, температура, pH-значение, а также свойства металла, такие как электрохимическая активность, состояние поверхности и толщина пленки окисла.
Какие процессы происходят на металл-электролитной границе при формировании электродного потенциала?
На металл-электролитной границе происходят два основных процесса: окисление металла и восстановление электролита. При окислении металла электрохимический акт осуществляется за счет выделения электронов, которые переходят в электролит. В то же время электролит восстанавливается за счет электронов, поступающих с электрода.
Какой эффект оказывает температура на формирование электродного потенциала на границе металл-электролит?
Температура оказывает существенное влияние на формирование электродного потенциала на границе металл-электролит. При повышении температуры скорость электрохимических реакций увеличивается, что приводит к ускорению процессов окисления металла и восстановления электролита, и, соответственно, к изменению электродного потенциала.
Как свойства металла влияют на формирование электродного потенциала на границе металл-электролит?
Свойства металла, такие как электрохимическая активность, состояние поверхности и толщина пленки окисла, существенно влияют на формирование электродного потенциала на границе металл-электролит. Различие в активности металла с электролитом определяет скорость окисления и восстановления, а состояние поверхности и толщина пленки окисла могут изменять скорость этих процессов и, следовательно, электродный потенциал.
