Метод электролиза расплава солей является одним из наиболее эффективных и распространенных способов получения щелочных металлов, таких как натрий, калий и литий. Этот метод основан на использовании электролиза для разрушения связей в солевых соединениях и получения чистых металлических элементов.
Процесс электролиза расплава солей осуществляется с помощью электролизера, в котором растворяются соли щелочных металлов. Затем в ячейке электролизера создается электрическое поле, которое вызывает разложение солей на положительно заряженные катионы металла и отрицательно заряженные анионы. Катионы металла притягиваются к отрицательно заряженному электроду (катоду) и осаждается на его поверхности в виде металлического осадка. Анионы, в свою очередь, движутся к положительно заряженному электроду (аноду) и там происходит их окисление или другие процессы.
Метод электролиза расплава солей имеет несколько преимуществ перед другими методами получения щелочных металлов. Во-первых, этот метод позволяет получать металлы высокой чистоты, так как процесс осаждения на катоде позволяет избежать примесей и нежелательных примесей. Во-вторых, этот метод достаточно энергоэффективен, так как энергия, потребляемая для разложения соли, обычно невысока. Кроме того, данный метод позволяет получать металлы в больших количествах, что делает его применимым для массового производства щелочных металлов.
Таким образом, использование метода электролиза расплава солей является важным способом получения щелочных металлов, который обеспечивает высокую чистоту металлов, энергоэффективность и возможность массового производства.
Процесс электролиза расплава солей для получения щелочных металлов
Метод электролиза расплава солей – один из основных способов получения щелочных металлов, таких как натрий и калий. Этот процесс основан на использовании электролиза, который позволяет разложить соль на составные части – катионы и анионы.
Перед началом процесса необходимо подготовить электролит, который представляет собой расплав соли, более часто хлорида натрия или калия. Для обеспечения электролиза необходимо обеспечить наличие электролитической ячейки, в которой находятся анод и катод. Анод обычно изготовлен из карбоната, катод – из металлической сетки.
Процесс электролиза начинается с подачи постоянного электрического тока на электролитическую ячейку. Под действием электрического тока происходит электролиз соли, в результате чего катионы металла перемещаются к катоду, а анионы сопровождаются реакцией окисления на аноде.
После прохождения электролиза и образования металлических катодов, процесс заканчивается и можно приступить к выделению щелочных металлов. Для этого производится охлаждение и удаление катодов, с последующей обработкой раствором кислоты. Результатом этого процесса является получение высокочистого металла, готового к использованию в различных областях промышленности и научных исследованиях.
Интересующие нас металлы

Метод электролиза расплава солей применяется для получения различных щелочных металлов, которые широко используются в промышленности и научных исследованиях.
Одним из наиболее популярных металлов, получаемых с помощью этого метода, является натрий. Натрий применяется во многих областях, включая производство щелочи, стекла и синтез органических соединений. Он также используется в пищевой промышленности в качестве консерванта и регулятора кислотности.
Калий также является важным металлом, получаемым с помощью метода электролиза расплава солей. Калий используется в сельском хозяйстве в качестве удобрения, а также для производства удобрений и взрывчатых веществ. Этот металл также применяется в процессах очистки сточных вод и производства стекла.
Литий - еще один щелочной металл, получаемый с помощью электролиза расплава солей. Литий используется в производстве легких металлических сплавов, литий-ионных аккумуляторов и лечении психических расстройств. Также этот металл применяется в космической промышленности и в процессе получения водорода.
Щелочные металлы, получаемые с помощью метода электролиза расплава солей, играют важную роль во многих отраслях промышленности и науки. Их уникальные свойства и широкий спектр применения делают их неотъемлемой частью современного общества.
Описание процедуры электролиза
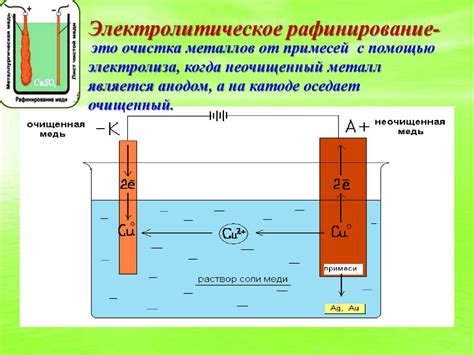
Электролиз – это процесс разложения вещества на ионы с помощью электрического тока. Процедура электролиза расплава солей используется для получения щелочных металлов, таких как натрий и калий.
Для проведения электролиза используют специальные электролитические ячейки, в которых находится расплав соли, например, хлорида натрия (NaCl). В ячейке имеются два электрода – анод и катод. Катод представляет собой отрицательно заряженный электрод, обычно сделанный из никеля или железа. Анод – это положительно заряженный электрод, часто изготавливающийся из металлической сетки или покрытый платиной.
При подключении электролитической ячейки к стабильному источнику электрического тока, начинается процесс электролиза. Под воздействием электрического тока происходит разложение соли на ионы. Положительно заряженные ионы катионы перемещаются к отрицательно заряженному катоду и накапливаются на его поверхности. Таким образом, на катоде образуется металлический осадок щелочного металла.
Одновременно с этим, отрицательно заряженные ионы анионы перемещаются к положительно заряженному аноду и погружаются в электролитический раствор, который находится в ячейке. На аноде происходит окисление этих ионов, что в результате приводит к выделению газа, например, хлора.
Таким образом, процедура электролиза расплава солей позволяет получить щелочные металлы, используя электрический ток. Этот метод широко применяется в промышленности для производства натрия, калия и других щелочных металлов, который имеют различные применения в разных отраслях производства.
Технические особенности электролиза

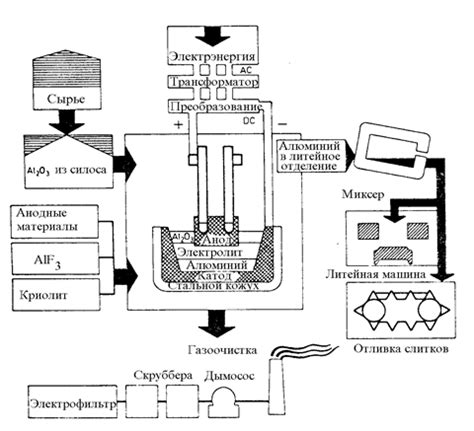
Электролиз расплава солей - это процесс, основанный на применении электрического тока для разложения солей и получения элементов. Он находит широкое применение в производстве щелочных металлов, таких как натрий и калий.
Основные технические особенности этого метода включают:
- Выбор электролита: для электролиза используются расплавы солей, которые являются проводниками электричества и позволяют разложить их на ионы. Чаще всего в качестве электролитов используются хлориды натрия и калия.
- Температура: электролиз проводится при высокой температуре, чтобы обеспечить плавление солей и поддержание проводимости электролита. Температура может достигать нескольких сотен градусов Цельсия.
- Расположение электродов: для проведения электролиза используются два электрода - анод и катод. Анод, на котором происходит окисление, изготавливают из материала, устойчивого к действию реагентов и высоким температурам. Катод, на котором происходит восстановление, обычно изготавливают из металла, который будет получен в результате электролиза.
- Плотность тока: оптимальная плотность тока зависит от конкретного процесса электролиза и может быть разной для разных металлов. Она должна быть настроена таким образом, чтобы обеспечить эффективное осаждение металла на катоде и минимизировать энергозатраты на процесс.
- Контроль параметров: электролиз проводится под строгим контролем, чтобы обеспечить стабильность процесса и предотвратить возможные нежелательные реакции или потери продукта. Контролируются такие параметры, как температура, плотность тока, время проведения электролиза и концентрация реагентов.
Технические особенности электролиза расплава солей играют важную роль в процессе получения щелочных металлов. Они обеспечивают эффективность процесса и позволяют получить высококачественные металлические продукты.
Приложения щелочных металлов
Литий - один из самых легких металлов, используется в производстве аккумуляторов высокой емкости, осветительных приборов, литий-ионных батарей и легких авиационных конструкций. Кроме того, литий используется в лекарствах для лечения психических расстройств и биполярного аффективного расстройства.
Натрий - важный элемент в производстве стекла, т.к. придает ему прозрачность и прочность. Кроме того, натрий используется в производстве мыла, моющих средств, отбеливателей и консервантов пищевых продуктов. В медицине натрий применяется для регулирования водно-солевого баланса организма.
Калий - необходим для нормального функционирования организма человека. Калий содержится в продуктах питания, таких как картофель, бананы, орехи. Калий используется в производстве удобрений, стекла, мыла и косметических средств. Кроме того, калий является важным компонентом в процессе производства электричества в биогазовых установках.
Рубидий - применяется в научных исследованиях в качестве ионового зонда, а также в электронике и лазерной технике. Рубидий также улучшает свойства стекла, используемого в производстве оптических приборов. Кроме того, рубидий применяется в медицине для лечения некоторых заболеваний сердца.
Цезий - применяется в ядерной энергетической промышленности для производства тепловых генераторов и радиоактивных источников энергии. Цезий используется также в производстве оптических приборов и в фотоэлементах. Кроме того, цезий применяется в медицине в качестве препарата для лечения рака и других заболеваний.
Таким образом, щелочные металлы нашли широкое применение в различных сферах человеческой деятельности, от промышленности до медицины, благодаря своим уникальным физическим и химическим свойствам.
Экологические аспекты метода электролиза
Метод электролиза расплава солей для получения щелочных металлов имеет свои экологические аспекты, которые необходимо учитывать при применении этого процесса. Одной из основных проблем является высокое энергопотребление, которое требуется для проведения электролиза. Для поддержания электрического тока необходимо постоянное энергоснабжение, что может привести к негативным последствиям для окружающей среды.
Кроме того, электролиз проводится в расплавленных солях, что требует использования высоких температур. Поддержание таких температур может потребовать значительного количества энергии и использования больших объемов топлива, что в свою очередь приводит к негативному воздействию на окружающую среду.
Еще одной проблемой является выброс продуктов электролиза, которые содержат вредные и токсичные вещества. Неконтролируемый выброс таких веществ может привести к загрязнению почвы и воды, вызывая негативное воздействие на экосистемы и здоровье живых организмов.
Однако, для уменьшения отрицательного влияния метода электролиза на окружающую среду, предпринимаются меры по совершенствованию технологических процессов. Введение новых методов снижения энергопотребления и улучшение систем очистки и утилизации отходов способствует улучшению экологической эффективности метода электролиза и снижает негативное воздействие на природные ресурсы.
В целом, несмотря на некоторые экологические проблемы, метод электролиза расплава солей для получения щелочных металлов является важным и широко используемым процессом. Технологические улучшения и правильная организация данного метода могут значительно снизить его негативный экологический след на планету.
Вопрос-ответ

Какой метод используется для получения щелочных металлов?
Для получения щелочных металлов применяется метод электролиза расплава солей.
Каким образом осуществляется электролиз расплава солей для получения щелочных металлов?
Электролиз расплава солей для получения щелочных металлов осуществляется путем погружения электродов соединенных с источником электрического тока в расплав соли, где происходят химические реакции и выделение щелочных металлов.
Какие реакции происходят в процессе электролиза расплава солей для получения щелочных металлов?
В процессе электролиза расплава солей для получения щелочных металлов происходят окислительно-восстановительные реакции, где ионы щелочных металлов снижаются до атомного состояния на катоде, а на аноде происходит окисление ионообразованных атомов щелочных металлов.
