Металлы являются одной из самых распространенных и важных групп элементов в периодической системе. Они представляют собой достаточно широкий класс веществ, которые обладают своеобразными физическими и химическими свойствами. Металлы обладают высокой электропроводностью и теплопроводностью, благодаря чему широко применяются в различных отраслях промышленности.
Строение атомов металлов тесно связано с их физическими свойствами. Атомы металлов имеют многочатленные энергетические уровни и сложную структуру оболочек. Однако, основной интерес для изучения металлов представляют внешние электроны. Именно они определяют возможность образования связей с другими атомами и дают возможность для проведения электрического тока в металлах.
Внешние электроны металлов обладают особыми свойствами. У них есть возможность свободно двигаться между атомами металла, что обеспечивает высокую электропроводность. В металлах, в отличие от других групп элементов, они образуют свободную электронную оболочку, благодаря чему металлы способны взаимодействовать с другими элементами и образовывать сплавы.
Металлы: основные элементы

Металлы - это класс элементов, отличающихся особыми свойствами и состоянием атомов. Они обладают характерным металлическим блеском, высокой теплопроводностью и электропроводностью. Металлы являются основными строительными материалами и находят применение в различных отраслях промышленности.
Одним из основных металлов является железо. Оно имеет атомный номер 26 и химический символ Fe. Железо является самым распространенным металлом на Земле и широко используется в производстве стали. Оно обладает высокой прочностью, структурной устойчивостью и способностью к деформации без разрушения.
Еще одним важным металлом является алюминий. Его атомный номер - 13, а химический символ - Al. Алюминий отличается легкостью, хорошей проводимостью тепла и электричества, а также хорошей коррозионной стойкостью. Он широко применяется в построении самолетов, автомобилей и в производстве упаковочных материалов.
Еще одним важным металлом является медь. Атомный номер меди - 29, а химический символ - Cu. Медь обладает высокой электропроводностью, хорошей гибкостью и коррозионной устойчивостью. Она широко используется в электротехнике, в производстве проводов и кабелей, а также в строительстве и производстве ювелирных изделий.
Другим важным металлом является свинец. Его атомный номер - 82, а химический символ - Pb. Свинец обладает низкой пластичностью, тяжелым весом и химической инертностью. Он широко используется в производстве аккумуляторов, кабелей, покрытий для защиты от радиации и других специальных применений.
Все эти металлы имеют свои характерные свойства и находят широкое применение в различных отраслях промышленности. Они являются основой современного технологического прогресса и играют важную роль в нашей повседневной жизни.
Металлы и их свойства

Металлы – это класс элементов, характеризующихся способностью проводить тепло и электричество, а также обладающих выраженным блеском и металлическим свойством.
Одной из основных характеристик металлов является их высокая пластичность, что позволяет им быть легко поддающимися формовке и созданию различных изделий. Благодаря этому свойству металлы широко применяются в промышленности для изготовления различных механизмов и конструкций.
У металлов также высокая теплопроводность и электропроводность, что объясняется наличием свободных электронов в их валентной оболочке. Это позволяет металлам быстро переносить тепло и электричество, что делает их незаменимыми материалами в области электротехники и теплотехники.
Важной особенностью металлов является их высокая температура плавления, что исключает использование их в виде газообразных или жидких веществ при комнатной температуре. Тем не менее, некоторые металлы, такие как галлий и ртуть, плавятся при низкой температуре, что позволяет использовать их в особых условиях.
Другим важным свойством металлов является образование оксидной пленки на их поверхности при взаимодействии с кислородом воздуха. Эта пленка защищает металл от дальнейшего окисления и коррозии, что делает их долговечными и устойчивыми к воздействию окружающей среды.
Металлы: атомы и структура
Металлы представляют собой класс элементов периодической системы, обладающих специфическими химическими и физическими свойствами. Единственное общее свойство всех металлов - это их способность проводить электрический ток. Это обусловлено наличием свободных электронов, которые легко передвигаются внутри металлической структуры.
Атомы металлов обладают особой структурой. В основе металлической структуры лежит решетка, состоящая из положительно заряженных ядер атомов, вокруг которых движутся свободные электроны. Энергия свободных электронов оказывается достаточно низкой, и они могут перемещаться по всему объему материала. Это позволяет металлам быть хорошими проводниками электричества и тепла.
Особенностью атомов металлов является также их способность образовывать межатомные связи с другими атомами. Такие связи формируются благодаря обмену свободными электронами между атомами. Это делает металлы пластичными и хорошо приспособленными для формования и литья.
Общая химическая формула металлов может быть представлена в виде AB, где A - катион металла, а B - анион. Атомы металлов выполняют роль ионов с положительным зарядом, поэтому в химических соединениях они обладают способностью получать электроны и образовывать ионы.
Структура металлов имеет огромное значение для их свойств. Отличительные свойства металлов - высокая теплопроводность, электропроводность, пластичность и прочность - прямо связаны с уникальной атомной структурой металлических материалов.
Строение атома металла
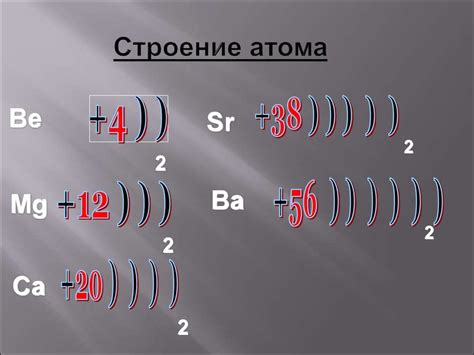
Атом металла является основным строительным блоком металлической структуры. Он состоит из ядра и внешних электронов.
Ядро атома металла содержит протоны и нейтроны. Протоны, имеющие положительный заряд, находятся в центре ядра, тогда как нейтроны, не имеющие электрического заряда, также содержатся в ядре. Число протонов в атоме называется атомным номером и определяет его химические свойства.
Вокруг ядра атома металла движутся электроны. Электроны имеют отрицательный электрический заряд и распределены в электронных оболочках. Самая близкая к ядру оболочка называется первой оболочкой или К-оболочкой, следующая называется второй оболочкой или L-оболочкой, и так далее.
Металлы отличаются от других типов элементов тем, что их внешняя оболочка содержит мало электронов. Это делает их хорошими проводниками электричества и тепла. Часто металлы образуют кристаллическую решетку, где атомы расположены регулярно и формируют повторяющуюся структуру.
Металлы: внешние электроны и их роль

Металлы - это элементы химической системы, которые обладают специфическими свойствами, такими как отличная теплопроводность, электропроводность и блеск. Одно из ключевых свойств металлов - наличие внешних электронов.
В атомах металлов внешний электрон, называемый валентным электроном, находится на самом внешнем энергетическом уровне. Он слабо связан с атомом и может легко переходить на другие атомы или образовывать связи с ними. Это делает металлы отличными проводниками электричества и тепла.
Внешние электроны в металлах играют ключевую роль в процессе формирования металлической связи. Когда атомы металла приближаются друг к другу, их внешние электроны оказываются общими для всего кристаллического решетчатого строения. Это обеспечивает высокую подвижность электронов и способность металлов проводить электрический ток.
Внешние электроны также определяют химическую активность металлов. Они могут быть переданы другим атомам или группам атомов при химических реакциях. Это позволяет металлам образовывать соединения с другими элементами и участвовать в различных химических процессах.
Поэтому внешние электроны в металлах играют важную роль в их физических и химических свойствах, обеспечивая металлам их уникальные характеристики. Благодаря этим свойствам металлы широко используются в различных отраслях промышленности, электротехнике и строительстве.
Валентные электроны металлов
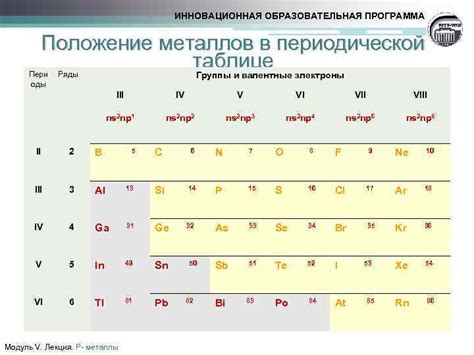
Валентные электроны металлов - это электроны, находящиеся на самом внешнем энергетическом уровне атома металла. Именно они играют ключевую роль в химическом поведении металлов и определяют их свойства.
Валентные электроны металлов отличаются от внутренних электронов, которые находятся на более низких энергетических уровнях. Внутренние электроны обеспечивают структурную целостность атома и не участвуют в химических реакциях.
Валентные электроны металлов обладают меньшей привязанностью к ядру атома по сравнению с внутренними электронами. Они могут перемещаться по кристаллической решетке металла и образовывать электронные облака.
Именно свободное движение валентных электронов в кристаллической решетке металла позволяет металлам обладать свойствами хорошего проводника электричества и тепла. Валентные электроны также определяют металлический блеск, который обуславливается отражением света от свободных электронов.
Количество валентных электронов металла определяет его химическую активность и способность к образованию химических связей. Оно обычно равно числу электронов в внешней оболочке металла и может быть определено по номеру группы в периодической системе.
Вопрос-ответ

Какие элементы являются металлами?
Металлами являются элементы, которые обладают характерными металлическими свойствами, такими как блеск, теплопроводность, электропроводность, пластичность и хорошая проводимость тепла.
Что такое атомы металлов?
Атомы металлов - это атомы химических элементов, которые имеют специфические свойства металлов, такие как блеск, теплопроводность, электропроводность и пластичность. В атомах металлов наружный энергетический уровень часто содержит небольшое количество внешних электронов, что обуславливает их характерные свойства.
