Аммиак (NH3) – одна из важнейших химических соединений, широко применяемых в различных отраслях промышленности. С его помощью производят удобрения, газы для холодильников и много других веществ. Однако известно, что аммиак может взаимодействовать с металлами, вызывая термические и химические реакции.
Основной вид реакции между аммиаком и металлами – образование амидов. При взаимодействии с аммиаком металлы образуют соединения типа M(NH2)2, где М – металл. Такие соединения обычно являются темноокрашенными и обладают высокой устойчивостью. Формирование амидов может происходить при обычных условиях температуры и давления, но в большинстве случаев требуется нагревание.
Важным свойством аммиака, определяющим его взаимодействие с металлами, является его амфотерность. Аммиак обладает как основными, так и кислотными свойствами. Это позволяет ему не только вступать в реакцию с металлами, но и образовывать с ними соли. Так, при взаимодействии с аммиаком некоторые металлы образуют гидроксиды, которые могут выступать в качестве оснований. Такое взаимодействие широко используется в аналитической химии для определения микроколичеств металлов в растворах.
Взаимодействие аммиака с металлами: синтез аммониевых соединений
Аммиак (NH3) является главным источником азота для многих химических процессов и промышленных производств. Одним из способов получения аммиака является его взаимодействие с металлами.
При взаимодействии аммиака с металлами образуются различные аммониевые соединения. Например, в результате реакции аммиака с литием образуется аммиаколитий (LiNH2). Это важное соединение может быть использовано в качестве химического источника аммиака или катализатора в различных химических процессах.
Взаимодействие аммиака с магнием приводит к образованию аммиаката магния (Mg(NH3)6), который является стабильным и легкорастворимым соединением. Аммиакат магния может использоваться в качестве источника аммиака при проведении реакций в аммиачной среде.
Кроме того, аммиак может взаимодействовать с другими металлами, такими как калий, натрий, кальций и т.д., образуя соответствующие аммониевые соединения. Эти соединения имеют широкий спектр применения, включая использование в качестве удобрений, катализаторов и средств для очистки воды.
Физические свойства аммиака

Аммиак (NH3) – это бесцветный газ с характерным резким запахом. Он обладает высокой теплотой испарения, поэтому при комнатной температуре находится в газообразном состоянии.
Аммиак легче воздуха и может распространяться быстро в окружающем пространстве. Он является легковоспламеняющимся газом, и его смесь с воздухом может быть взрывоопасной при определенных условиях. Поэтому при работе с аммиаком необходимо быть крайне осторожным.
Аммиак обладает хорошими растворительными свойствами. В воде он растворяется с образованием аммиака-водного раствора, известного как аммиак. Аммиак также растворяется в некоторых органических растворителях, таких как этиловый спирт и этер.
Температура кипения аммиака составляет -33,35 °C, а его плотность равна 0,737 г/см3. Он не образует кислоты или основания, но обладает амфотерными свойствами и может образовывать соли аммония с органическими и неорганическими кислотами.
Аммиак обладает высокой теплопроводностью и может использоваться в холодильных системах в качестве хладагента. Кроме того, аммиак также применяется в производстве удобрений, лекарств, пластмасс и других продуктов.
Окисление аммиака в присутствии металлических катализаторов

Окисление аммиака является важной реакцией, которая может проходить в присутствии металлических катализаторов. Под воздействием катализатора происходит активация молекулы аммиака, что позволяет его окислить.
Одной из самых известных реакций, происходящих при окислении аммиака, является образование азота и воды. При этом аммиак расщепляется на азот и водород, которые дальше реагируют с кислородом, образуя соответственно азот и воду. Эта реакция особенно интересна с точки зрения промышленности, так как азот и водород являются важными сырьевыми компонентами для многих процессов.
Катализаторы, которые используются для окисления аммиака, могут быть различными металлами, такими как платина, родий, железо и другие. Также катализаторы могут быть представлены в виде специально созданных пористых материалов, на которых нанесены металлические частицы.
Окисление аммиака в присутствии металлических катализаторов можно проводить при различных условиях, включая температуру и давление. Высокая температура обычно способствует активации реакции и повышению скорости окисления. Однако, важно подобрать оптимальные условия, чтобы избежать нежелательных побочных реакций.
Таким образом, окисление аммиака в присутствии металлических катализаторов является важным процессом, который можно применять в различных отраслях промышленности для получения полезных продуктов и сырья.
Применение аммиака в синтезе амина из аммиака
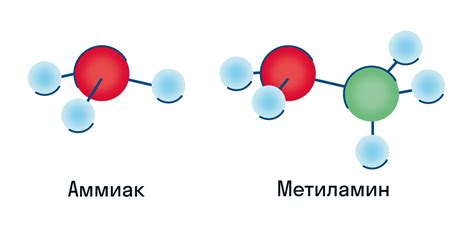
Аммиак — одно из самых важных веществ в органической химии и применяется в различных синтезах аминов. Способы получения аминов из аммиака включают реакции аминации, амидирования и редукции.
Одним из основных методов синтеза аминов из аммиака является аминация. В этом процессе аммиак служит исходным материалом для образования новой химической связи с молекулой органического соединения. Аминация позволяет синтезировать широкий спектр аминов, включая простые и сложные, а также ароматические амины.
Аммиак может также использоваться в амидировании, при котором в результате реакции с кислотами образуются амиды. Реакция амидирования часто проводится при повышенных температурах и давлениях с использованием катализаторов, чтобы увеличить скорость и выход продукта.
Еще одним способом получения аминов из аммиака является их синтез через редукцию. Одним из примеров является реакция аммиака с алдегидами или кетонами, что приводит к образованию соответствующих аминов. Редукция может проводиться различными веществами, такими как литий алюминий гидрид или гидриды бора, в присутствии катализаторов.
Таким образом, аммиак является важным источником для получения аминов путем аминации, амидирования и редукции. Эти реакции позволяют синтезировать различные классы аминов с широким спектром применений в органической химии и промышленности.
Вопрос-ответ

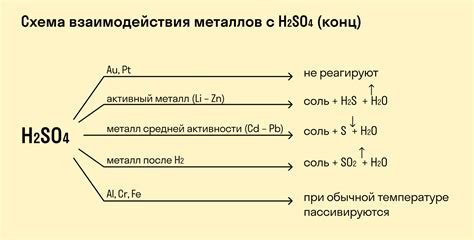
Какие металлы вступают в реакцию с аммиаком?
Аммиак может реагировать с многими металлами, включая некоторые щелочные и щелочноземельные металлы, такие как натрий, калий, магний и алюминий.
Какие реакции происходят при взаимодействии аммиака с металлами?
Главной реакцией, которая происходит при взаимодействии аммиака с металлами, является образование амидов. Например, аммиак реагирует с натрием, образуя амид натрия и водород. 2NH₃ + 2Na → 2NaNH₂ + H₂
Какие свойства имеют амиды металлов?
Амиды металлов обладают рядом интересных свойств. Они являются сильными щелочами и могут реагировать с кислотами. Также амиды металлов хорошо растворяются в воде и образуют щелочные растворы.
Какую роль играет аммиак в электролизе растворов металлов?
Аммиак играет важную роль в электролизе растворов металлов. Он может служить как растворитель для растворения металлических ионов, так и электролитом для проведения электрического тока. Кроме того, аммиак может образовывать со своим амидом стабильные комплексы с ионами металлов, что значительно повышает эффективность процесса электролиза.
